Aurélie Guérin , Cynthia Tanguay , Denis Lebel , Jean-François Bussières
L’encadrement de la recherche clinique repose sur des textes internationaux pivots, tels que la déclaration d’Helsinki (1964)1, le rapport Belmont (1979)2 et les lignes directrices de la Conférence internationale sur l’harmonisation ( International Conference on Harmonisation [ICH]) (1996)3. Fondé en 1990, l’ICH publie des lignes directrices sur le thème de l’efficacité de la recherche clinique, dont le thème E6 portant sur les bonnes pratiques cliniques (BPC)3. Les BPC décrivent les responsabilités et les fonctions de toutes les parties prenantes à la conduite d’essais cliniques, à savoir les promoteurs, les chercheurs, les moniteurs et les comités d’éthique de la recherche (CER). Les BPC ont depuis été adoptées dans plusieurs juridictions, dont le Canada en 19974. L’ Énoncé de politique des trois conseils est également un texte pivot sur l’éthique de la recherche au Canada (mis à jour en 2010)5.
Les BPC3 ne comportent aucun critère spécifique à la pratique pharmaceutique hormis la mention du terme « pharmacie », à titre de secteur de soutien, comme l’imagerie médicale, les laboratoires, etc. Néanmoins, plusieurs sociétés savantes se sont exprimées sur le rôle du pharmacien et la nature des services pharmaceutiques requis en soutien à la recherche clinique.
Aux États-Unis, l’American Society of Health-System Pharmacists a publié en 1997 des lignes directrices sur la recherche clinique, qu’elle a mises à jour en 20036. L’American College of Clinical Pharmacists a également publié une série de documents sur le rôle du pharmacien en recherche7. On retient notamment de ces réflexions le fait que le pharmacien peut être chercheur principal de projets de recherche clinique et d’évaluation des pratiques pharmaceutiques.
En France, la Société Française de Pharmacie Clinique a publié en 1998 le Manuel d’auto-évaluation de la Pharmacie Hospitalière , qui présente 66 points d’évaluation8. Le Référentiel de Pharmacie Hospitalière 9 publié en 2010 met en avant trois critères pour la gestion des essais cliniques. Les trois critères sont la mise en place d’une organisation facilitant la réalisation des essais, la maîtrise du circuit des produits de santé expérimentaux et la garantie de la confidentialité relative aux essais cliniques9.
Au Canada, la Société canadienne des pharmaciens d’hôpitaux a publié en 1997 des lignes directrices sur la recherche pharmaceutique en établissement de santé10 et, en 2001, des lignes directrices sur l’utilisation des médicaments pour des essais cliniques en établissement de santé11. De plus, la Société a publié en 2011 un énoncé sur la conduite et le soutien des activités de recherche12 et des lignes directrices sur la conduite de recherche en pratique pharmaceutique13.
Les modes opératoires normalisés (MON) sont des « instructions détaillées et écrites visant à assurer l’accomplissement uniforme d’une fonction particulière »4. L’élaboration et l’utilisation des MON assurent une description adéquate des procédures, mais le suivi réellement effectué quant à leur application sur le terrain est faible. Bien que les BPC aient été publiées il y a 16 ans, il n’existe pas d’outil canadien permettant l’autoévaluation de la pratique pharmaceutique en recherche clinique en établissement de santé. L’élaboration d’un tel outil d’autoévaluation du soutien pharmaceutique aux essais cliniques permettrait un processus continu d’amélioration de la qualité et de l’uniformité des pratiques. Deux articles publiés récemment14,15 démontrent l’intérêt de directives plus claires pour l’application des BPC en pratique pharmaceutique. Ainsi, Méthot et coll.14 décrivent les exigences requises pour une gestion et un service optimaux des produits de recherche. Siden et coll.15 décrivent un outil servant de modèle aux pharmaciens en vue de l’élaboration d’instructions pour l’organisation des activités de service de médicament, de tenue d’inventaire et de gestion des produits de recherche.
L’objectif principal est de développer une grille d’autoévaluation du soutien pharmaceutique aux essais cliniques en établissement de santé et de proposer une méthode d’utilisation de cette grille.
Une assistante de recherche a extrapolé les variables des BPC applicables à la pratique pharmaceutique. En complément, les lignes directrices de l’American Society of Health-System Pharmacists (2003)6, de la Société Française de Pharmacie Clinique (1998)8 et de la Société canadienne des pharmaciens d’hôpitaux (2011)13 ont été consultées. Le dernier rapport relatif aux inspections de Santé Canada16 a également été consulté.
Les variables identifiées ont été regroupées en domaines selon un ordonnancement du général au spécifique. Un critère d’évaluation a été formulé pour chaque variable identifiée. La grille préliminaire développée a été discutée puis approuvée par les membres de l’équipe de recherche de ce projet lors de réunions en avril 2012. L’équipe de recherche de ce projet était constituée du pharmacien responsable du service pharmaceutique de soutien aux essais cliniques (D.L., 13 ans d’expérience en gestion d’essais cliniques), de la coordonnatrice du service pharmaceutique de soutien aux essais cliniques (C.T., deux ans d’expérience), d’un pharmacien hospitalier validant régulièrement les ordonnances de recherche (J-F.B., 16 ans d’expérience), et d’une assistante de recherche (A.G., six mois d’expérience).
Du 16 au 25 mai 2012, quatorze pharmaciens hospitaliers collaborant au soutien à la recherche clinique au sein de centres hospitaliers québécois de plus de 100 lits ont été sollicités pour évaluer la clarté et le caractère évaluable de chaque critère d’une grille préliminaire. Chaque personne interrogée devait répondre par écrit et de façon dichotomique quant à la clarté (c.-à-d. oui/non) et au caractère évaluable (c.-à-d. oui/non) de chaque critère. Les sondés étaient invités à soumettre des commentaires.
Si la clarté et le caractère évaluable d’un critère donné atteignaient un taux de satisfaction inférieur à 80 %, l’équipe de recherche entamait une réflexion en vue de le remanier. Aucune analyse statistique n’a eu lieu.
En juin 2012, l’équipe de recherche a mis au point une méthode d’utilisation de la grille d’autoévaluation et de la périodicité de son utilisation.
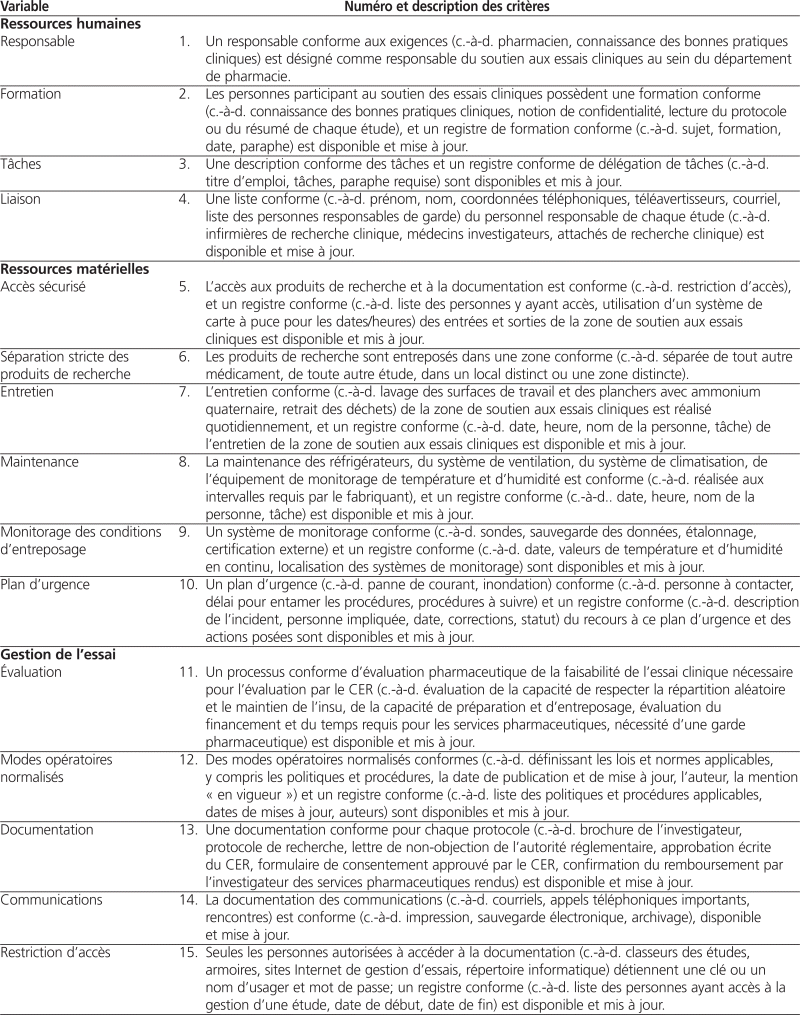
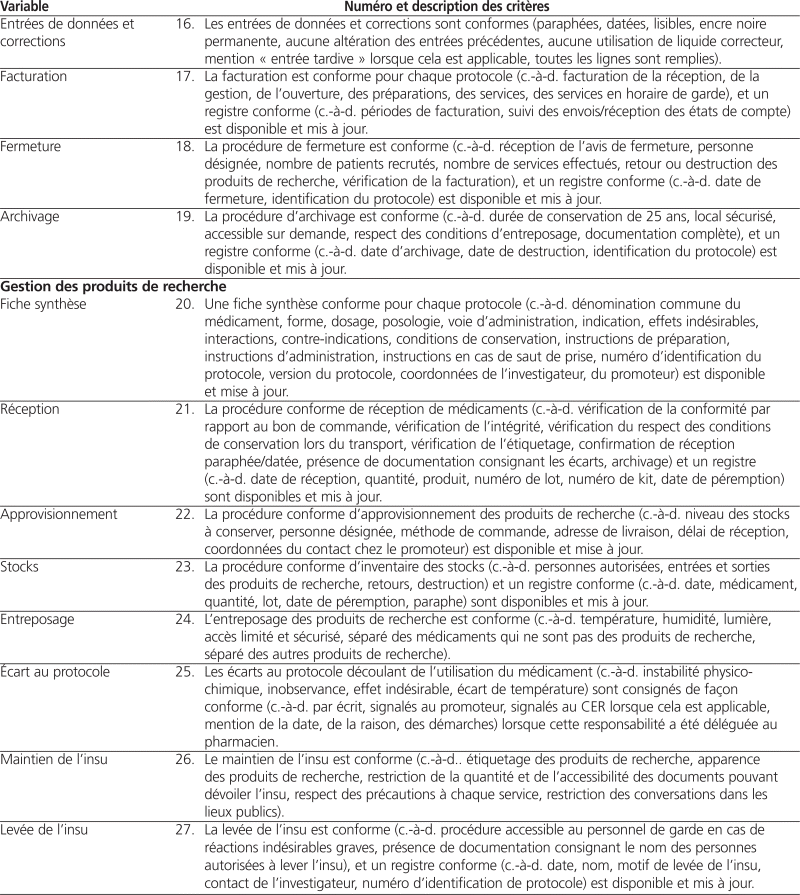
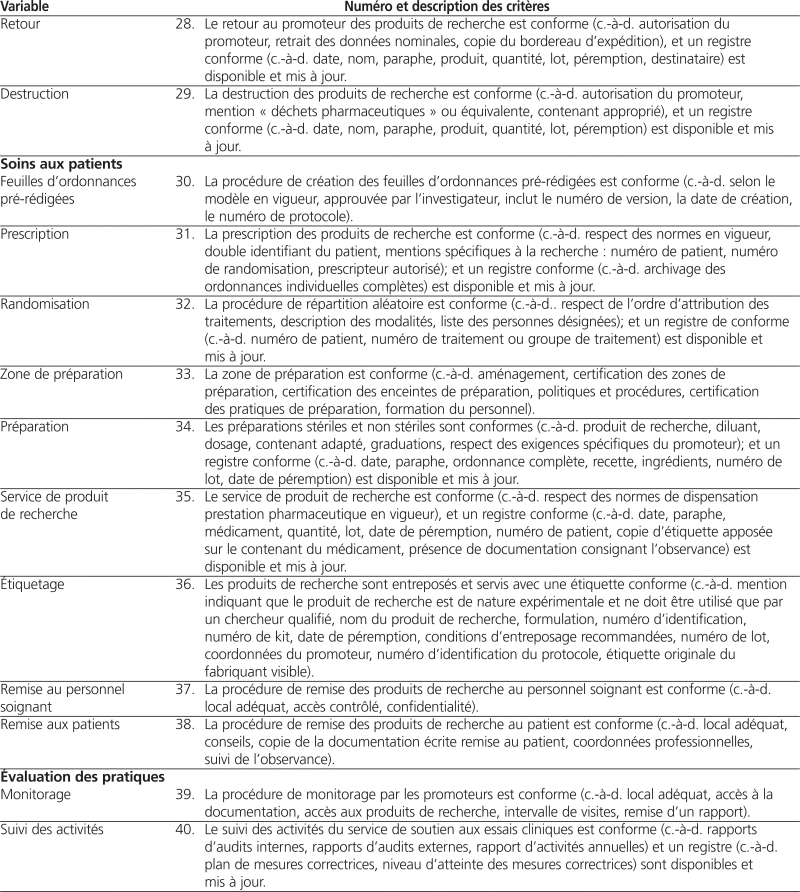
L’équipe de recherche a identifié 40 variables correspondants à 40 critères répartis dans les six domaines suivants : ressources humaines, ressources matérielles, gestion de l’essai, gestion des produits de recherche, soins aux patients et évaluation des pratiques.
Douze des 14 pharmaciens hospitaliers sollicités ont donné leur opinion sur la clarté et le caractère évaluable de la grille d’autoévaluation préliminaire. Quarante (100 %) critères ont été jugés clairs par au moins 10 des 12 sondés, tandis que 26 (65 %) critères ont été jugés évaluables par au moins 10 des 12 sondés. Seul un critère a été jugé évaluable par moins de la moitié des personnes consultées (variable « communication »). Tous les commentaires reçus ont été pris en compte, et des améliorations ont été apportées aux critères jugés peu clairs ou non évaluables. Le tableau 1 présente la grille d’autoévaluation du soutien aux essais cliniques après intégration des commentaires reçus.
Tableau 1.
Grille d’autoévaluation du soutien aux essais cliniques



Nous pensons qu’il est raisonnable de prévoir une autoévaluation annuelle. Une période de temps prédéterminée devrait être consacrée à cet exercice. Pour chaque critère, trois sections seront remplies : détails de l’autoévaluation, actions correctrices prévues et notes. La figure 1 présente un exemple d’autoévaluation pour la variable « réception ». L’outil d’autoévaluation développé peut être utilisé selon la méthode suivante :
Indication de la présence ou de l’absence d’un MON applicable et à jour.
Autoévaluation par le responsable du soutien pharmaceutique aux essais cliniques; celui-ci peut inscrire sa perception de la conformité de son service au moyen de commentaires. Le responsable a également l’occasion de consigner les cas d’exception, par exemple, s’il sait que ses procédures ne sont pas respectées dans une certaine étude en raison d’une demande contraire de la part du promoteur.
Attribution d’une note par le responsable (conforme, partiellement conforme ou non conforme) en fonction de la présence d’une MON et de son autoévaluation.
Réalisation de cas traceurs. Selon Agrément Canada, un traceur est « une méthode d’évaluation qui est composée d’une variété d’activités, telles que la consultation de documents, l’observation de la prestation des services (…), dans le but de recueillir des renseignements sur la façon dont l’organisme offre les services et gère ses activités quo-tidiennes »17. Si une note non conforme a été attribuée à un critère, des cas traceurs ne sont pas obligatoires. Pour une note conforme ou partiellement conforme, les cas traceurs permettent de vérifier l’application des procédures et de confirmer la note attribuée. Au moins deux cas traceurs devraient être identifiés. Les cas traceurs peuvent être réalisés par le responsable ou par un évaluateur externe, un autre pharmacien, un stagiaire, etc.
Corrections et planification des actions correctrices. Chaque observation doit faire l’objet d’une action correctrice dans la colonne vis-à-vis. Les actions correctrices peuvent être réalisées immédiatement si l’observation est mineure (par exemple, initiale manquante). Sinon, un commentaire sur son implantation prochaine sera formulé (par exemple, développement d’un MON prévu à la fin de l’année).
Confirmation de la note attribuée à la suite de la réalisation des cas traceurs.
|
|
||
|
Figure 1. Exemple d’autoévaluation pour la variable « réception ». C = conforme, PC = partiellement conforme, NC = non conforme, MON = mode opératoire normalisé. La note est attribuée par le responsable du soutien pharmaceutique aux essais cliniques en fonction de la présence d’une MON, et de son autoévaluation de la situation. Si une évaluation de NC est attribuée, il n’est pas nécessaire de faire des cas traceurs. Une note C implique la présence d’une MON et la da présence de documentation consignant les exceptions aux procédures s’il y a lieu. Une note C devrait être confirmée à la suite des cas traceurs. Les nombres encerclés représentent l’ordre suggéré de l’autoévaluation. Se référer à la section « Utilisation de la grille d’autoévaluation » du texte pour des instructions supplémentaires. |
||
Même si tous les critères ont été jugés « clairs », certains critères sont difficilement « évaluables ». Par exemple, le critère d’archivage des communications, y compris les appels téléphoniques, est problématique compte tenu de la quantité importante des documents et de la difficulté à vérifier a posteriori l’archivage de la totalité des communications. La formulation de ces critères a été améliorée. Les critères considérés comme difficilement évaluables ont néanmoins été conservés afin que la grille d’autoévaluation soit un outil complet visant à trouver les lacunes et à déterminer les améliorations à prioriser dans un service pharmaceutique de soutien à la recherche clinique.
La grille donne beaucoup d’importance aux MON. Nous sommes d’avis que la présence d’un MON (ou d’une politique et procédure) est nécessaire à l’attribution d’une note « conforme ». Méthot et coll. ont d’ailleurs récemment fait le point sur l’utilisation des bonnes pratiques cliniques en établissement de santé et ont mis en évidence l’importance de recourir à des MON (c.-à-d. standard operating procedures ) et de s’assurer que soit menée une évaluation de toutes les étapes du circuit du médicament14.
Si, au nom de l’objectivité ou de l’effet surprise, plusieurs organismes de certification externe n’ont pas tendance à rendre disponibles les outils d’autoévaluation utilisés lors des inspections, nous pensons que la diffusion de telles grilles est profitable, qu’elle permet une meilleure préparation et un processus d’amélioration de la qualité plus constant. On n’a qu’à penser aux outils offerts par les organismes d’agrément, tels qu’Agrément Canada, pour s’en convaincre. Ainsi, le dernier rapport relatif aux inspections de Santé Canada16 a été un élément ayant contribué à l’établissement de la grille préliminaire d’autoévaluation. Göbel et coll. ont également souligné la nécessité d’harmoniser les procédures et les outils d’inspection entre les autorités compétentes ainsi que le partage des résultats, afin d’accroître la conformité aux BPC18.
Nous prévoyons créer un document GoogleDoc partagé afin de mettre à jour la grille selon notre expérience d’utilisation. Toute personne intéressée à utiliser la grille pour sa propre autoévaluation est invitée à communiquer avec nous afin de collaborer aux mises à jour de la grille selon les commentaires reçus. La collaboration et le partage des expériences d’autoévaluation permettront de s’assurer que la grille soit plus facilement évaluable et qu’elle soit mise à jour régulièrement.
Bien que la grille ait été validée auprès d’un groupe de 12 pharmaciens collaborant au soutien aux essais cliniques, une étude réalisée à partir d’une véritable autoévaluation de la pratique pourrait en améliorer le contenu. Une nouvelle mesure de la clarté et du caractère évaluable de la grille n’a pas été faite à la suite des nouvelles améliorations. La grille n’a pas été développée sur la base de la faisabilité ou des retombées économiques des critères. Certains critères peuvent être plus difficiles à mettre en place ou à financer selon les écarts observés au sein de chaque établissement.
Si les BPC ne sont pas spécifiques à la pratique pharmaceutique, notre outil d’autoévaluation s’en inspire et traduit en termes pharmaceutiques les attentes que l’on peut avoir envers un pharmacien hospitalier contribuant au soutien à la recherche clinique. La grille est composée de 40 critères répartis en six domaines, soit les ressources humaines, les ressources matérielles, la gestion de l’essai, la gestion des produits de recherche, les soins aux patients et l’évaluation des pratiques. La grille a été améliorée à la suite de l’évaluation de pharmaciens participant à la recherche clinique. Une autoévaluation annuelle à l’aide de notre outil pourra mettre en évidence des éléments de non-conformité au sein de chaque établissement. Si l’outil vise à accroître la conformité aux bonnes pratiques cliniques, nous pensons qu’il peut aussi contribuer à une meilleure gestion des essais cliniques. Il serait bon de développer des outils similaires d’autoévaluation pour encadrer le travail d’autres professionnels, notamment celui des infirmières coordonnatrices de recherche clinique, afin d’instaurer plus fermement l’application des BPC pour chaque profession.
1. Déclaration d’Helsinki de l’AMM – Principes éthiques applicables à la recherche médicale impliquant des êtres humains. Ferney-Voltaire (France) : Association médicale mondiale; 1964, amendée 2008. Publié au : www.wma.net/fr/30publications/10policies/b3/. Consulté le 25 juillet 2012.
2. Protection des sujets humains. Rapport Belmont : principes éthiques et directives concernant la protection des sujets humains dans le cadre de la recherche. Washington (DC) : Commission nationale pour al Protection des sujets humains dans le cadre de la recherche biomédicale et béhavioriste; 1979. Publié au : www.fhi360.org/training/fr/RETC/pdf_files/FrenchBelmont.pdf. Consulté le 25 juillet 2012.
3. ICH Expert Working Group. ICH harmoised tripartite guideline. Guideline for good clinical pratice E6 (R1). Genève (Suisse) : International conference on harmonisation of technical requirements for registration of pharmaceuticals for human use; 1996. Publié au : www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E6_R1/Step4/E6_R1__Guideline.pdf. Consulté le 29 mai 2012.
4. Ligne directrice à l’intention de l’industrie. Les bonnes pratiques cliniques : directives consolidées ICH thème E6. Ottawa (ON) : Santé Canada, Direction générale des produits de santé et des aliments; 1997. Publié au : www.hc-sc.gc.ca/dhp-mps/alt_formats/hpfb-dgpsa/pdf/prodpharma/e6-fra.pdf. Consulté le 29 mai 2012.
5. Énoncé de politique des trois conseils : Éthique de la recherche avec des êtres humains. Ottawa (ON) : Conseil de recherches en sciences humaines du Canada, Conseil de recherche en sciences naturelles et en génie du Canada, Instituts de recherche en santé du Canada; 2010. Publié au : www.ger.ethique.gc.ca/pdf/fra/eptc2/EPTC_2_FINALE_Web.pdf. Consulté le 29 mai 2012.
6. American Society of Health-System Pharmacists. ASHP guidelines on clinical drug research. Am J Health Syst Pharm 1998;55(4):369-376. Révisé en 2003. Publié au : www.ashp.org/DocLibrary/BestPractices/ResearchGdlClinical.aspx. Consulté le 29 mai 2012.
7. White papers: research. Lenexa (KS) : American College of Clinical Pharmacy. Publié au : www.accp.com/govt/positionpapers.aspx#White_Papers_title. Consulté le 29 mai 2012.
8. Manuel d’auto-évaluation de pharmacie hospitalière. France : Société Française de Pharmacie Clinique; 1998. Publié au : www.optimiz-sih-circ-med.fr/documents/sfpc-manuel-autoevaluation-1998.pdf. Consulté le 20 mai 2012.
9. Référentiel de pharmacie hospitalière Version 2010. France : Société française de pharmacie clinique; 2011. Publié au : www.sfpc.eu/fr/item1/finish/3-documents-sfpc-public/20-referentiel-de-pharmacie-hospitaliere-sfpc-v2010/0.html. Consulté le 20 mai 2012.

10. Lignes directrices sur la recherche pharmaceutique en établissement de santé. Ottawa (ON) : Société canadienne des pharmaciens d’hôpitaux; 1997. Publié au : www.cshp.ca/dms/dmsView/1_G_Research_FR_1997.pdf. Consulté le 20 mai 2012.
11. Lignes directrices sur l’utilisation des médicaments pour des essais clin-iques en établissement de santé. Ottawa (ON) : Société canadienne des pharmaciens d’hôpitaux; 2001. Publié au : hwww.cshp.ca/dms/dmsView/1_G_Clinical_Trials_FR_2001.pdf. Consulté le 20 mai 2012.
12. Recherche : énoncé sur la conduite et le soutien des activités de recherche. Ottawa (ON) : Société canadienne des pharmaciens d’hôpitaux; 2011. Publié au : www.cshp.ca/. Consulté le 20 mai 2012.
13. Research : guidelines on conducting research in pharmacy. Ottawa (ON) : Société canadienne des pharmaciens d’hôpitaux; 2011. Publié au : www.cshp.ca/. Consulté le 20 mai 2012.
14. Méthot J, Brisson D, Gaudet D. On-site management of investigational products and drug delivery systems in conformity with Good Clinical Practices (GCPs). Clin Trials 2012;9(2):265–271.
15. Siden R, Tamer HR, Skyles AJ, Weadock S, Redic K. Pharmacist-prepared dispensing guidelines for drugs used in clinical research. Am J Health Syst Pharm 2012;69(12):1021–1026.
16. Rapport sommaire des inspections d’essais cliniques réalisés d’avril 2004 à mars 2011. Ottawa (ON) : Santé Canada, Inspectorat de la direction générale des produits de santé et des aliments; 2012. Publié au : www.hc-sc.gc.ca/dhp-mps/compli-conform/clini-pract-prat/report-rapport/2004-2011-fra.php. Consulté le 20 mai 2012.
17. Foire aux questions. Ottawa (ON) : Agrément Canada; 2009. Publié au : www.accreditation.ca/fr/content.aspx?pageid=1064&langType=3084. Consulté le 20 mai 2012.
18. Göbel C, Baier D, Ruhfus B, Hundt F. GCP inspections in Germany and Europe following the implementation of the Directive 2001/20/EC. Ger Med Sci 2009;7:Doc01.

Canadian Journal of Hospital Pharmacy , VOLUME 65 , NUMBER 6 , November-December 2012