Marika Lepage-Légaré, Sandrine Léger, Hugo Ricignuolo, Gabrielle St-Louis, Thomas Joly-Mischlich
Depuis quelques années, l’immunothérapie est utilisée dans le traitement antinéoplasique et son efficacité se démontre pour un nombre grandissant d’indications. Un de ses effets est dû à la stimulation du système immunitaire par l’inhibition des points de contrôle, ce qui permet l’activation des lymphocytes T afin qu’ils exercent leur effet cytotoxique sur les cellules tumorales1. Cette stimulation du système immunitaire est toutefois associée à de possibles réactions indésirables à médiation immunitaire et à un risque de réactivation de maladies auto-immunes1,2. Le cas présenté dans cet article décrit une réaction rapide de nécrolyse épidermique toxique (NET) associée à la prise d’ipilimumab (anti-CTLA4) et de nivolumab (anti-PD1) par une patiente souffrant d’un mélanome métastatique.
Il s’agit d’une femme de 58 ans, pesant 90 kg, mesurant 158 cm et sans allergie médicamenteuse connue.* Elle souffre d’hypertension artérielle, de diabète de type II et d’hypothyroïdie. Elle a reçu un nouveau diagnostic de mélanome métastatique avec une mutation V600E sur le gène BRAF. Trois métastases cérébrales ont initialement causé deux épisodes convulsifs, ce pourquoi elle s’est vu prescrire du lévétiracétam. La patiente préférant la double immunothérapie à une simple immunothérapie ou à une thérapie anti-BRAF, elle entreprend un premier traitement constitué de quatre doses d’ipilumumab à raison de 3 mg/kg et de nivolumab à raison de 1 mg/kg toutes les trois semaines. Elle reçoit son premier cycle au jour 0 (J0).
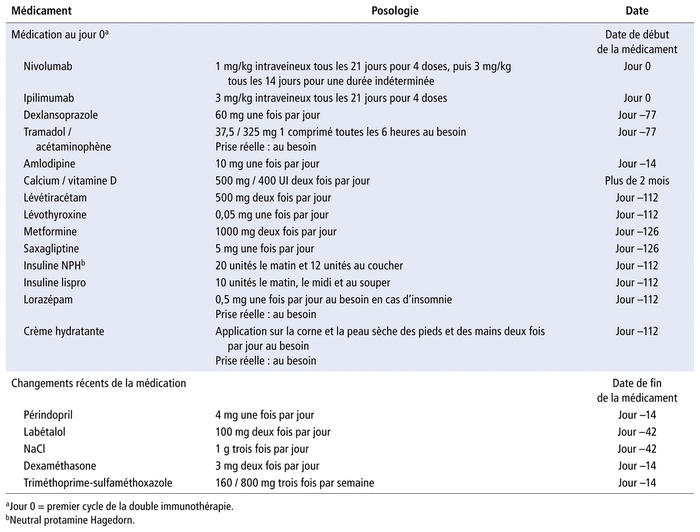
Au J6, elle se présente à l’urgence pour une éruption cutanée qui progresse rapidement, apparue dans son dos au J3. Au J5, elle présente un épisode de lipothymie sans conséquence significative. À l’évaluation initiale, les lésions maculopapulaires érythémateuses s’étendent sur plus de 30 % de la surface corporelle (SC). La patiente reçoit un traitement de prednisone dosé à 90 mg (1 mg/kg/jour), de diprosone topique à appliquer deux fois par jour et de 50 mg de diphenhydramine intraveineux toutes les six heures au besoin. Elle a une créatinine sérique de base de 60 μmol/L, mais elle présente une insuffisance rénale aiguë avec une créatinine sérique de 108 μmol/L au J6, résolue par un soluté de réhydratation. Au J7, on note une augmentation légère de l’alanine aminotransférase (ALT) à 43 UI/L (valeur normale: 0–37 UI/L) comparativement à 22 UI/L une semaine avant l’immunothérapie. Ses autres résultats de laboratoire sont normaux. Une histoire médicamenteuse a été réalisée à l’arrivée de la patiente (tableau 1). Du J8 au J10, la réaction cutanée progresse jusqu’à atteindre 65 à 70 % de sa SC et des phlyctènes apparaissent sur 20 % de celle-ci. Le signe de Nikolsky est positif et les trois muqueuses sont atteintes. Son score de Scorten est estimé à 4/10 et est associé à 58 % de risque de décès3. Un dermatologue confirme la suspicion d’un syndrome de Stevens-Johnson (SSJ) évoluant vers une NET. Au J10, trois biopsies ont été réalisées et des photos de la réaction ont été prises (figure 1). Au J11, l’éruption cutanée couvre 90 % de la SC et les phlyctènes, plus de 20 %. Puisque la réaction progresse rapidement, la patiente est transférée à l’unité des grands brûlés d’un centre hospitalier tertiaire, où elle reçoit des soins de plaie adaptés et de la prednisone à raison de 2 mg/kg/jour. Elle n’a pas reçu de cyclosporine, d’etanercept ni d’immunoglobulines. Lors de ce séjour, les lésions cutanées évoluent en cellulite multigermes traitée avec du meropenem pendant 11 jours.
TABLEAU 1 Histoire médicamenteuse à l’admission
|
|
||
|
FIGURE 1 État de la réaction cutanée 10 jours après l’administration d’une première dose d’ipilimumab et de nivolumab. |
||
Après une évolution favorable des lésions, au J32, la patiente est à nouveau transférée à son hôpital d’appartenance. Un débalancement de son diabète sous corticostéroïdes suivi en endocrinologie et une pneumonie à Pneumocystis jiroveci pour laquelle elle a reçu un traitement de triméthoprime-sulfaméthoxazole de 21 jours prolongent son hospitalisation. Le traitement a été bien toléré et elle a obtenu son congé de l’hôpital au J56. À son départ, elle a reçu une ordonnance de sevrage de prednisone et de suivi en dermatologie. La patiente a reçu de la prednisone pendant cinq mois.
Le résultat des biopsies démontre une nécrose épidermique presque complète avec un discret infiltrat dermique lymphohistiocytaire périvasculaire et les immunofluorescences directes sont négatives; le résultat tend donc à confirmer la présence d’une NET.
Plusieurs éléments ont mené au diagnostic de NET chez cette patiente. Le malaise qui l’a menée à consulter à l’urgence s’apparente au prodrome précédant une NET, et l’éruption érythémateuse qui a rapidement progressé en phlyctènes et en desquamation est caractéristique d’une réaction cutanée causée par un médicament. Par ailleurs, l’atteinte des trois muqueuses et le signe de Nikolsky positif orientaient aussi vers ce diagnostic confirmé par une biopsie. Un score de Naranjo de sept indique que la NET a probablement été causée par la combinaison d’ipilimumab et de nivolumab4 et c’est aussi ce qu’ont conclu les cliniciens.
Quelques rapports de cas de SSJ et de NET portant sur l’ipilimumab et le nivolumab sont présentés dans la littérature scientifique. Dans un premier cas, une femme de 64 ans traitée pour un mélanome métastatique réfractaire à l’ipilimumab a développé ces symptômes quatre semaines après le début d’un traitement au nivolumab5. Dans ce cas, l’ajout d’immunoglobulines et de cyclosporine à la cortisone à haute dose a permis de contenir la réaction. Dans un deuxième cas6, un homme de 62 ans, traité pour un mélanome métastatique, a développé une NET au jour 4 après le deuxième cycle de double immunothérapie, soit 25 jours après le début du traitement. Malgré la prise en charge du patient par l’ajout d’immunoglobulines et de cyclosporine, il est décédé d’une défaillance d’organes multiples. Un autre patient de 54 ans traité pour un lymphome folliculaire a développé une NET 10 jours après la première dose de nivolumab7. Ce cas est intéressant, puisque le patient prenait d’autres médicaments qui pouvaient être associés à ce type de réaction, soit de l’allopurinol, le triméthoprime-sulfaméthoxazole et le fluconazole7. Finalement, un cas similaire à celui de notre patiente concerne un homme de 57 ans qui a développé une NET seulement six jours après la première administration d’ipilimumab et de nivolumab pour traiter un adénocarcinome gastro-œsophagien8.
Environ 37 à 70 % des patients traités avec l’ipilimumab développent une toxicité cutanée, dont 1 à 3 % de grade 3 ou supérieur. De façon générale, 30 à 50 % des patients sous immunothérapie développent une toxicité cutanée durant leur traitement2. La monographie de l’ipilimumab9 indique que le délai médian d’apparition d’une réaction cutanée à médiation immunitaire est de 3,1 semaines, ce qui correspond aussi au délai d’action du médicament sur les lymphocytes T. La monographie du nivolumab10 indique que le délai médian d’apparition de réactions cutanées de grade 3 à médiation immunitaire lorsqu’il est combiné à l’ipilimumab pour le traitement d’un mélanome est de deux semaines et que la fréquence de telles réactions est plus élevée lorsqu’il est utilisé en combinaison.
Bien que le mécanisme sous-jacent à la NET induite par l’immunothérapie ne soit pas clairement élucidé, plusieurs hypothèses ont été émises. D’abord, l’augmentation de l’activité antitumorale des lymphocytes T pourrait être le déclencheur de réactions auto-immunes contre les kératinocytes. Ensuite, les anti PD-1 peuvent compromettre l’intégrité de l’épithélium, mais il est difficile de déterminer si ce phénomène peut contribuer au développement d’une NET11. Certains auteurs ont envisagé la possibilité que la comédication augmente les risques de développer une NET10. L’immunothérapie pourrait être le déclencheur d’une réaction d’hypersensibilité cutanée favorisée par la prise de médicaments connus pour en augmenter le risque.
Concernant les autres médicaments pris par la patiente, la mention du SSJ apparaît dans quelques monographies de produits, comme le dexlansoprazole12, le tramadol-acétaminophène13 et la saxagliptine14, mais l’incidence n’est pas précisée. Concernant le lévétiracétam, l’incidence de SSJ serait supérieure à celle de la population générale et surviendrait en moyenne après 12 jours15. Toutefois, la patiente prenait ces médicaments depuis plus longtemps et aucun n’a été retiré durant le traitement. Concernant l’amlodipine, il y a moins de 0,1 % de cas de SSJ selon la monographie16 et la littérature scientifique ne décrit que peu de cas portant sur cet agent. Dans le cas présent, l’amlodipine a d’abord été suspectée comme cause potentielle de la NET, puisque son administration avait débuté deux semaines avant la réaction. Mais cette hypothèse a été écartée, puisque le médicament a été repris pendant l’hospitalisation sans aggravation de la réaction. Il faut également prendre en considération le triméthoprime-sulfaméthoxazole que la patiente venait de commencer à prendre. Bien que le traitement se soit terminé 14 jours avant la réaction, le risque de SSJ est connu avec cet antibiotique17. Il est donc raisonnable d’affirmer qu’aucun de ces médicaments n’était directement en cause dans ce cas-ci, mais on ne peut exclure leur implication une fois l’inhibition lymphocytaire levée.
La revue de littérature confirme que des réactions de SSJ et de NET sont possibles avec la prise d’ipilimumab et de nivolumab, ce qui renforce la thèse postulant que cette patiente a réagi à cette double immunothérapie. L’intérêt du cas vient du fait que la réaction est survenue seulement trois jours après l’exposition à ces agents, alors que des délais de 7 à 140 jours sont mentionnés dans les autres rapports de cas18. Selon plusieurs références, le délai d’apparition d’un SSJ ou d’une NET varierait d’une à quatre semaines après le début du traitement médicamenteux, mais pourrait aller jusqu’à huit semaines19,20. Devant l’incertitude à propos des rôles respectifs de l’immunothérapie et des autres médicaments augmentant le risque de réaction d’hypersensibilité cutanée, il conviendrait de prendre en considération ce risque de réaction sévère dans l’évaluation globale précédant la prescription d’une immunothérapie.
En conclusion, ce cas illustre la survenue d’une NET chez une femme de 58 ans traitée pour un mélanome métastatique avec la combinaison d’ipilimumab et de nivolumab. La rapidité de l’apparition de la réaction après le début de l’immunothérapie est surprenante lorsqu’on la compare avec ce que rapporte la littérature disponible.
1 Hassel JC, Heinzerling L, Aberle J, Bähr O, Eigentler TK, Grimm MO, et al. Combined immune checkpoint blockade (anti-PD-1/anti-CTLA-4): evaluation and management of adverse drug reactions. Cancer Treat Rev. 2017(57):36–49.
Crossref PubMed
2 Brahmer JR, Lacchetti C, Schneider BJ, Atkins MB, Brassil KJ, Caterino JM, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol. 2018;36(17):1714–68.
Crossref PubMed PMC
3 Cohen V. Toxic epidermal necrolysis (TEN). Medscape; le 20 décembre 2018. Consulté sur intranet, Université de Montréal.
4 Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30(2):239–45.
Crossref PubMed
5 Nayar N, Briscoe K, Fernandez Penas P. Toxic epidermal necrolysis-like reaction with severe satellite cell necrosis associated with nivolumab in a patient with ipilimumab refractory metastatic melanoma. J Immunother. 2016;39(3):149–52.
Crossref PubMed
6 Logan IT, Zaman S, Hussein L, Perrett CM. Combination therapy of ipilimumab and nivolumab-associated toxic epidermal necrolysis (TEN) in a patient with metastatic melanoma: a case report and literature review. J Immunother. 2020;43(3):89–92.
Crossref
7 Griffin LL, Cove-Smith L, Alachkar H, Radford JA, Brooke R, Linton KM. Toxic epidermal necrolysis (TEN) associated with the use of nivolumab (PD-1 inhibitor) for lymphoma. JAAD Case Rep. 2018;4(3):229–31.
Crossref PubMed PMC
8 Kubicki SL, Welborn ME, Patel AB. Toxic epidermal necrolysis during cotherapy with ipilimumab and nivolumab. J Immunother Precis Oncol. 2018;1(2):78–81.
Crossref
9 Yervoy product monograph. Bristol-Myers Squibb Canada; le 13 janvier 2020.
10 Opdivo product monograph. Bristol-Myers Squibb Canada; le 30 octobre 2019.
11 Fay AP, Brandão Moreira P, Nunes Filho PRS, Albuquerque C, Barrios CH. The management of immune-related adverse events associated with immune checkpoint blockade. Expert Rev Qual Life Cancer Care. 2016:1(1):89–97.
Crossref
12 Dexilant product monograph. Takeda Canada Inc; le 6 janvier 2020.
13 Auro-tramadol/acetaminophen product monograph. Auro Pharm Inc; le 28 juin 2018.
14 Onglyza product monograph. AstraZeneca Canada Inc; le 12 décembre 2018.
15 Levetiracetam product monograph. Sivem Produits Pharmaceutiques ULC; le 17 juin 2017.
16 GD-amlodipine product monograph. Pfizer Canada Inc; le 23 octobre 2017.
17 Sulfatrim product monograph. AA Pharma Inc; le 17 janvier 2019.
18 Chen CB, Wu MY, Ng CY, Lu CW, Wu J, Kao PH, et al. Severe cutaneous adverse reactions induced by targeted anticancer therapies and immunotherapies. Cancer Manag Res. 2018;10:1259–73.
Crossref PubMed PMC
19 Sassolas B, Haddad C, Mockenhaupt M, Dunant A, Liss Y, Bork K, et al. ALDEN, an algorithm for assessment of drug causality in Stevens-Johnson syndrome and toxic epidermal necrolysis: comparison with case-control analysis. Clin Pharmacol Ther. 2010;88(1):60–8.
Crossref PubMed
20 Law RM, Law DTS. Dermatologic drug reactions and common skin conditions. Dans: DiPiro JT, Talbert RL, Yee GC, Matzke GR, Wells BG, Posey LM, rédacteurs. Pharmacotherapy: a pathophysiologic approach. 10e édition. McGraw-Hill Education; 2017.
Conflits d’intérêts: Aucune déclaration. ( Return to Text )
*Le consentement écrit de la famille de la patiente a été obtenu pour publier ce rapport de cas et les images qui lui sont associées, conformément aux exigences du comité d’éthique de la recherche de l’établissement concerné. ( Return to Text )
Financement: Aucune reçue. ( Return to Text )
Canadian Journal of Hospital Pharmacy, VOLUME 74, NUMBER 3, Summer 2021