Aurélie Bleuse, Hélène Roy, Denis Lebel, Philippe Ovetchkine, Julie Blackburn, Jean-François Bussières
RÉSUMÉ
Contexte
L’émergence de résistances aux antibiotiques a contribué à créer des bactéries multirésistantes, et ceci constitue une préoccupation majeure.
Objectifs
L’objectif principal était d’explorer l’association possible entre la consommation d’antibiotiques et l’émergence de résistance dans un centre hospitalier universitaire mère-enfant.
Méthode
Il s’agit d’une étude rétrospective menée dans un centre hospitalier universitaire. Des couples antibiotique-bactérie ont été établis, en tenant compte du nombre d’isolats, de l’utilisation réelle d’antibiotique et de la pertinence clinique des couples. Pour chaque couple, une comparaison de deux variables (consommation d’antibiotiques et pourcentage de résistance) a été quantifiée par un coefficient de Pearson. Trois analyses ont été considérées : sans décalage entre les données d’utilisation et de résistance, décalage d’un an et décalage de deux ans.
Résultats
Trente couples ont été sélectionnés en hémato-oncologie et 18 couples en néonatologie. En hémato-oncologie, six couples avaient une corrélation positive (Pearson > 0,7), deux couples impliquant le méropénem, deux la ceftazidime et deux la pipéracilline-tazobactam. Dans trois cas, la corrélation s’observe sans décalage entre les données de consommation et de résistance. En néonatologie, trois couples avaient une corrélation positive, un impliquant la vancomycine, un la cloxacilline et un le méropénem.
Conclusions
Il est possible d’explorer l’association qui peut exister entre la consommation d’antibiotiques et l’émergence de résistance dans un centre. L’approche exploratoire reposait sur un traitement manuel des données. Il pourrait être intéressant d’envisager une approche systématique continue permettant la production automatique de corrélations.
MOTS CLÉS: antimicrobiens, résistance, bon usage, antibiogouvernance
Abstract
Background
The emergence of antibiotic resistance has contributed to the development of multidrug-resistant bacteria, which is a major concern.
Objectives
The primary objective was to explore the possible association between antibiotic use and the emergence of resistance in a mother-child university hospital.
Method
This retrospective study was conducted in a university hospital centre. Antibiotic-bacteria pairs were established, taking into account the number of isolates, actual antibiotic use, and clinical relevance. For each pair, a comparison of 2 variables (antibiotic utilization and rate of resistance) was quantified with the Pearson coefficient. Three analyses were conducted: no lag between utilization and resistance, 1-year lag, and 2-year lag.
Results
Thirty antibiotic-bacteria pairs were selected from hematology-oncology and 18 from neonatology. In hematology-oncology, 6 pairs had a positive correlation (Pearson coefficient > 0.7): 2 pairs involving meropenem, 2 involving ceftazidime, and 2 involving piperacillin-tazobactam. In 3 of these cases, there was no lag between consumption of antibiotics and presence of resistance. In neonatology, 3 antibiotic-bacteria pairs had a positive correlation, 1 each involving vancomycin, cloxacillin, and meropenem.
Conclusions
It is possible to explore the potential association between consumption of antibiotics and emergence of resistance in a particular centre. Our exploratory approach was based on manual data processing. It would be interesting to consider a continuous systematic approach, allowing automatic generation of correlations.
KEYWORDS: antimicrobials, resistance, appropriate use, antibiotic management
La découverte des antibiotiques et leur utilisation en médecine remontent à moins d’un siècle et constituent une avancée importante de la médecine. Dès les premières années d’utilisation, l’apparition de résistances aux antibiotiques et l’émergence de bactéries multirésistantes ont été observées1,2. Ces bactéries constituent un problème de santé publique, car elles deviennent difficiles à traiter et contribuent à des échecs thérapeutiques associés à la morbidité et à la mortalité. Strathdee et al. rapportent que l’antibiorésistance est associée à plus de 700 000 morts par an dans le monde et qu’elle serait associée à la mort d’environ 10 millions de personnes par an d’ici 2050, ce qui coûtera 100 000 milliards de dollars à l’économie mondiale en raison d’une perte de productivité3. Au Canada, plusieurs organismes surveillent l’émergence de résistance, tels que le Canadian Antimicrobial Resistance Surveillance System4 et le Programme canadien de Surveillance des infections nosocomiales5 de l’Agence de la santé publique du Canada ou l’initiative Canadian Antimicrobial Resistance Alliance6.
L’Organisation mondiale de la santé (OMS) a fait de la prévention et la gestion de la résistance aux antibiotiques une priorité stratégique en 20157. Le plan proposé comporte cinq objectifs, soit « d’améliorer la sensibilisation et la compréhension de la résistance aux antimicrobiens, de renforcer la surveillance et la recherche pour réduire l’incidence des infections, de réduire l’incidence des infections, d’optimiser l’utilisation des médicaments antimicrobiens et d’assurer un investissement durable dans la lutte contre la résistance aux antimicrobiens »7.
Du fait de leur résistance à certains antibiotiques et du nombre important d’infections, sept bactéries sont sous l’attention particulière de l’OMS. Parmi ces bactéries, trois sont à l’origine d’infections en milieu hospitalier : Escherichia coli résistant aux céphalosporines de 3e génération et aux fluoroquinolones, Klebsiella pneumoniae résistant aux céphalosporines de 3e génération et aux carbapénèmes et Staphylococcus aureus résistant à la méticilline8. Le plan d’action mondial pour combattre la résistance aux antimicrobiens prévoit que chaque état membre doit fournir des programmes de bonne gestion afin de contrôler et d’optimiser l’emploi des anti-infectieux au niveau national9.
Dans la même optique, l’OMS a aussi développé la classification AWaRe pour l’ensemble des antibiotiques. Le classement des antibiotiques propose trois groupes pour optimiser leur utilisation : le groupe « Access » comprend 48 antibiotiques ne comportant pas d’enjeu de résistance pour le moment, le groupe « Watch » compte 110 antibiotiques à haut risque de résistances et le groupe « Reserve » comporte 22 antibiotiques dont l’usage doit être limité et contrôlé10.
Au Canada, une pratique organisationnelle exigeant une gérance des antimicrobiens a contribué à la collecte et à l’analyse de données de consommation des antibiotiques dans le cadre des activités d’antibiogouvernance menées dans chaque établissement de santé11. Au Québec, le comité sur les infections nosocomiales du Québec (CINQ) a publié un rapport sur les infections nosocomiales et l’intérêt d’assurer une surveillance de l’utilisation des antimicrobiens12. Dans la foulée de ce rapport, le ministère de la Santé et des Services sociaux a publié en 2011 une circulaire administrative afin d’assurer la mise en œuvre d’un programme de surveillance de l’usage des antibiotiques en établissement de santé13. De plus, le CINQ a mis en place un Comité central de surveillance provinciale des infections nosocomiales14. En réponse à cette circulaire administrative, chaque établissement de santé du Québec collige annuellement des données de consommation de ses antimicrobiens. Au Québec, Delisle et al. ont publié le profil de leur antibiogramme cumulatif15.
Afin de profiter des données colligées périodiquement, nous nous sommes intéressés à l’utilisation des antimicrobiens et à l’émergence de résistance à ces médicaments au sein de notre établissement. Nous proposons une méthodologie génératrice d’hypothèse pour alimenter les travaux d’équipes en antibiogouvernance.
Il s’agit d’une étude rétrospective et descriptive. L’objectif principal était d’explorer l’association possible entre la consommation d’antibiotiques et l’émergence de résistance dans un centre hospitalier universitaire mère-enfant.
L’étude se déroule dans un centre hospitalier universitaire mère-enfant de 500 lits. Deux clientèles ont été ciblées, soit l’hémato-oncologie et la néonatologie, comme il s’agit de sous-populations homogènes dans notre établissement en termes de caractéristiques de patients et d’habitudes d’utilisation d’antibiotiques par les prescripteurs. L’étude porte sur les données de consommation de 2005–2006 à 2017–2018 et les données de résistance de 2007–2008 à 2017–2018. Ce recul additionnel de deux ans de consommation a été retenu de façon arbitraire, en présumant un délai minimal nécessaire à la détection de la résistance.
Les données de résistance reposant sur un minimum de 30 isolats en moyenne par année et par unité de soins ont été considérées. Un nombre insuffisant d’isolats pouvait être corrigé par le regroupement d’années ou d’espèces semblables (les données détaillées sont disponibles sur demande auprès de l’auteur correspondant). Les données recueillies provenaient de l’antibiogramme cumulatif institutionnel. L’antibiogramme est produit selon les balises du Clinical and Laboratory Standards Institute16. Une valeur de sensibilité intermédiaire a été recodée comme résistante.
En pédiatrie, la consommation d’antibiotiques est mieux décrite par jours de traitement que par dose définie journalière17,18. Ainsi, le nombre de jours de traitements (JT) a été extrait pour chaque antibiotique et pour chaque unité d’hospitalisation à partir du dossier pharmacologique informatisé (GesphaRx, CGSI TI). Par la suite, le nombre de jours de traitement pour 1000 jours-présences (JT/1000JP) a été calculé pour chaque antibiotique par unité d’hospitalisation. Les données de consommation reposant sur un minimum de 10 JT/1000JP en moyenne par année ont été considérées (seuil décidé arbitrairement). Les antibiotiques sélectionnés étaient: amikacine, amoxicilline-acide clavulanique, ampicilline, céfazoline, céfixime, ceftazidime, ceftriaxone, ciprofloxacine, clindamycine, cloxacilline, erythromycine, gentamicine, lévofloxacine, linézolide, méropénem, nitrofurantoïne, pipéracilline-tazobactam, rifampicine, tobramycine, triméthoprime-sulfaméthoxazole (TMP-SMX) et vancomycine.
Afin d’explorer l’association possible entre la consommation d’antibiotiques et l’émergence de résistance, des couples antibiotique-bactérie ont été établis, en tenant compte du nombre d’isolats (minimum de 30 isolats en moyenne par année), de l’utilisation réelle d’antibiotique (au moins 10 JT/1000JP en moyenne) et de la pertinence clinique des couples.
Pour chaque couple identifié, une comparaison des deux variables (consommation d’antibiotiques (JT) et pourcentage de résistance) a été quantifiée par le calcul d’un coefficient de Pearson. Trois points de vue ont été considérés : analyse sans décalage (c.-à-d. les données d’utilisation et de résistance proviennent de la même année), analyse avec décalage d’un an (c.-à-d. les données d’utilisation précèdent d’une année les données de résistance) et analyse avec décalage de deux ans entre la consommation et les résistances observées. De façon arbitraire, les données illustrant une corrélation supérieure à 0,7 ont été illustrées. Seules des statistiques descriptives ont été effectuées.
En hémato-oncologie pédiatrique, 2653 requêtes d’antibiogramme ont été réalisées pour 1319 dossiers de patients entre 2007–2008 et 2017–2018. Les bactéries Escherichia coli, Staphylococcus aureus et Staphylococcus epidermidis présentaient un nombre suffisant d’isolats. En raison de leur nombre insuffisant d’isolats par année, les bactéries Enterobacter spp, Citrobacter spp, Morganella spp et Serratia spp ont été regroupées pour former le groupe des Entérobactéries. Pour ce qui est de Klebsiella spp, Enterococcus spp, Pseudomonas spp, Staphylocoques coagulase négative (SCN), le nombre insuffisant d’isolats par année a été corrigé par le regroupement de 2 années successives. Les autres bactéries n’ayant pas atteint le nombre moyen de 30 isolats par année ont été exclues.
En néonatologie, 2653 requêtes d’antibiogramme ont été réalisées pour 1535 dossiers de patients entre les années 2007–2008 et 2017–2018. Les bactéries Enterococcus spp. Escherichia coli, Klebsiella spp et trois espèces de Staphylococcus (S. aureus, S. epidermidis, SCN) présentaient un nombre suffisant d’isolats. En raison de leur nombre insuffisant d’isolats par année, les bactéries Enterobacter spp, Citrobacter spp, Morganella spp et Serratia spp ont été regroupées pour former le groupe Entérobactéries. En raison du nombre toujours insuffisant d’isolats, les autres bactéries n’ont pas été retenues pour l’étude.
La description de la consommation d’antibiotiques en JT/1000JP pour le service d’hémato-oncologie est disponible sur demande auprès de l’auteur correspondant. Les antibiotiques sélectionnés pour l’étude dans le service d’hémato-oncologie étaient les suivantes : ceftazidime, ceftriaxone, ciprofloxacine, cloxacilline, lévofloxacine, méropénem, pipéracilline-tazobactam, tobramycine, TMP-SMX et vancomycine. Les autres n’atteignaient pas la consommation moyenne de 10 JT/1000JP et ont été exclus.
La description de la consommation d’antibiotiques en JT/1000JP pour le service de néonatologie est disponible sur demande auprès de l’auteur correspondant. Les antibiotiques sélectionnés pour l’étude dans le service de néonatologie étaient les suivantes : ampicilline, cloxacilline, gentamicine, linézolide, méropénem, pipéracilline-tazobactam et vancomycine. Les autres n’atteignaient pas la consommation moyenne de 10 JT/1000JP et ont été exclus.
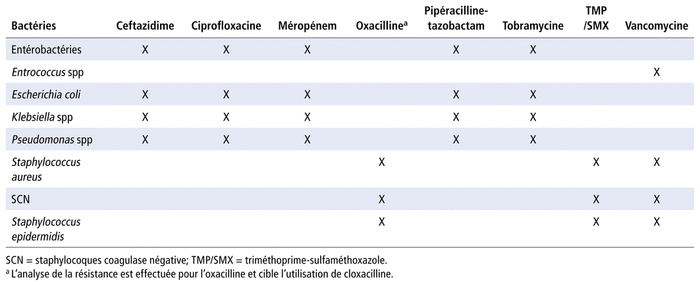
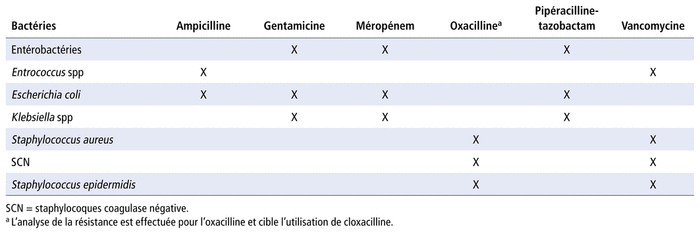
Après la sélection des bactéries et des antibiotiques, des couples bactérie-antibiotique ont été sélectionnés en fonction de la pertinence clinique. Trente couples ont été sélectionnés en hémato-oncologie (tableau 1) et dix-huit couples en néonatologie (tableau 2). Les données d’évolution des pourcentages de résistance aux antibiotiques pour ces couples respectifs sont disponibles sur demande auprès de l’auteur correspondant.
TABLEAU 1 Couples sélectionnés en hémato-oncologie

TABLEAU 2 Couples sélectionnés en néonatologie
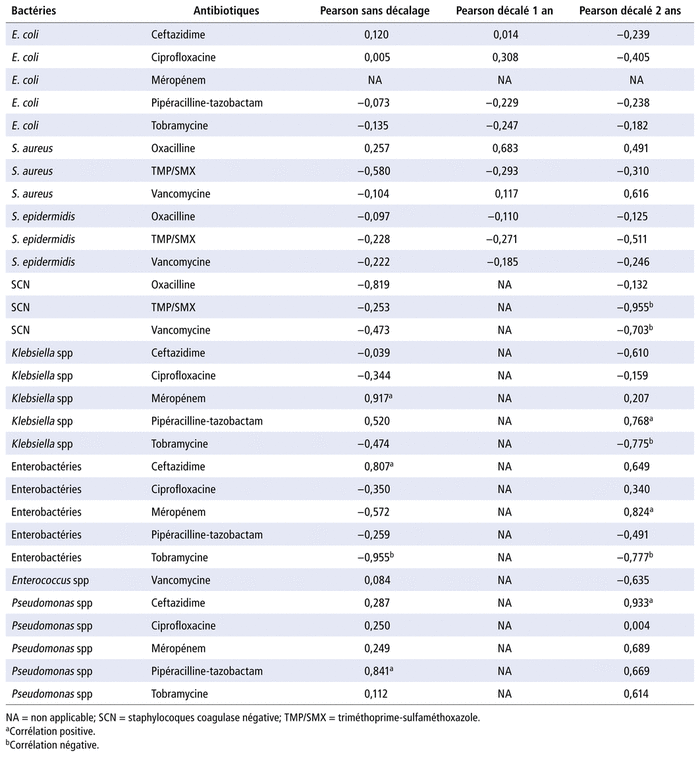
L’analyse de chaque couple sélectionné en hémato-oncologie est présentée (tableau 3). Les couples présentant une corrélation positive (valeurs entre 0,7 et 1) sans décalage d’années entre la consommation des antibiotiques (JT) et les résistances sont Klebsiella spp-méropénem (0,92), Pseudomonas spp-pipéracilline-tazobactam (0,84) et entérobactéries-ceftazidime (0,81). Les couples présentant une corrélation positive avec décalage de deux ans entre la consommation des antibiotiques et les résistances sont Pseudomonas spp-ceftazidime (0,93), entérobactéries-méropénem (0,82) et Klebsiella spp-pipéracilline-tazobactam (0,77) (tableau 3, figure 1).
|
| ||
|
FIGURE 1 Représentation graphique des couples présentant une corrélation positive en hémato-oncologie pédiatrique. JT = nombre de jours de traitement. | ||
TABLEAU 3 Corrélation entre l’évolution de la consommation d’antibiotiques et l’évolution des résistances aux antibiotiques pour le service d’hémato-oncologie
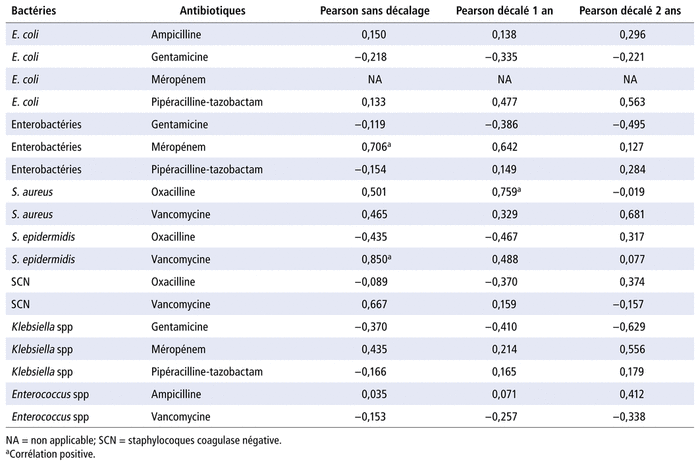
L’analyse de chaque couple sélectionné en néonatologie est présentée (tableau 4). Les couples présentant une corrélation positive (valeurs entre 0,7 et 1) sans décalage d’années entre la consommation des antibiotiques (JT) et les résistances sont Staphylococcus epidermidis-vancomycine (0,85) et entérobactéries-méropénem (0,71). Le couple présentant une corrélation positive avec décalage d’une année entre la consommation des antibiotiques et les résistances est Staphylococcus aureus-oxacilline (0,76) (tableau 4, figure 2).
|
| ||
|
FIGURE 2 Représentation graphique des couples présentant une corrélation positive en néonatologie. JT = nombre de jours de traitement. | ||
TABLEAU 4 Corrélation entre l’évolution de la consommation d’antibiotiques et l’évolution des résistances aux antibiotiques en néonatologie
Grammatico-Guillon et collab. ont évalué l’effet d’un programme d’antibiogouvernance en pédiatrie (c.-à-d. programme multidisciplinaire qui met à contribution l’expertise de médecins, pharmaciens et autres professionnels pour assurer le bon usage des antimicrobiens)19. Un index a également été créé pour considérer le spectre des antibiotiques en plus du volume d’utilisation; il facilite également les comparaisons entre hôpitaux20. Des 16 programmes inclus dans la revue narrative, un seul a contribué à la réduction des résistances aux antibiotiques.
Ainsi, Horikoshi et collab. ont noté une corrélation positive entre le taux de résistance aux carbapénèmes chez Pseudomonas aeruginosa et le nombre de JT (0,76, p = 0,04)21. Le taux de résistance (p < 0,01) et le nombre de JT (p < 0,01) ont diminué de manière significative dans la période post-intervention visant un usage optimal. Les auteurs de cette revue narrative notent que bien que l’antibiogouvernance soit une pratique exemplaire, il existe très peu de données sur les retombées de ce type de programme sur l’antibiorésistance21.
Bell et collab. ont effectué une revue systématique afin d’explorer le lien entre l’utilisation d’antimicrobiens et la prévalence de résistance à ces agents22. Des 243 études retenues, les auteurs notent une relation positive et statistiquement significative entre la consommation d’antimicrobiens et la résistance, mais la modélisation par régression multiple n’a pas permis d’identifier des variables prédictrices. Les auteurs notent que ce lien d’association est plus fort dans les pays du sud de l’Europe. Costelloe et collab. ont également noté un lien entre l’utilisation et la résistance23. Shapiro et collab. ont mis en évidence que la forte consommation d’antibiotiques a une plus forte influence sur l’incidence des infections par les pathogènes les plus résistants24.
Dans notre étude, nous observons une corrélation positive (c.-à-d. supérieure à un coefficient de Pearson de 0,7) pour six couples antibiotique-bactérie en hémato-oncologie, soit deux couples impliquant le méropénem, deux pour la ceftazidime et deux pour la pipéracilline-tazobactam. Dans trois cas, la corrélation s’observe sans décalage entre les données de consommation et les données de résistance tandis que dans trois autres cas, la corrélation repose sur un décalage de deux années entre la consommation et les résistances. L’utilisation courante de bêta-lactamines en milieu communautaire explique possiblement, en partie, la relation observée entre l’utilisation de certains agents et l’émergence de résistance. De même, nous observons une corrélation positive pour trois couples antibiotique-bactérie en néonatologie soit un couple impliquant la vancomycine, un couple impliquant la cloxacilline et un couple impliquant le méropénem. L’importance relative de la consommation des antibiotiques est à noter. En effet, on constate des corrélations positives pour des niveaux de consommation différents, par exemple la consommation de méropénem est en moyenne de 52,2 JT/1000JP par année en hémato-oncologie et de 10,3 JT/1000JP par année en néonatologie. Dans tous ces cas, ces données exploratoires ne permettent pas d’établir un lien de causalité entre l’utilisation d’un antibiotique et l’antibiorésistance ni de statuer sur la pertinence ou non de décaler les données de consommation et de résistance. Elles illustrent toutefois le lien qui peut exister entre l’utilisation d’un antimicrobien et l’émergence de résistance.
Dans son rapport 2019, le Centers for Disease Control and Prevention américain a commenté l’évolution des résistances aux antibiotiques en comparant les données de 2013 à celles de 201925. Le centre note que la résistance des entérobactéries aux carbapénèmes est stable tandis que la résistance des entérocoques à la vancomycine est en baisse.
En revanche, notre étude met en évidence de nombreux couples bactérie-antibiotique pour lesquels il n’existe pas de lien d’association ou même pour lesquels on constate une corrélation négative. Il est important de rappeler que l’épisode de soins d’un patient constitue généralement une très courte fenêtre de son parcours. La résistance à un antibiotique peut s’installer progressivement et il faut plusieurs années pour être en mesure d’observer une tendance et possiblement un lien entre l’utilisation d’antibiotiques et cette évolution de la résistance. Notre étude décrit une approche exploratoire effectuée dans le cadre de notre programme d’antibiogouvernance. Elle permet aux cliniciens de discuter de l’antibiogramme cumulatif, en mettant en perspective les données d’utilisation. Nous pensons qu’elle contribue davantage à la réflexion et à l’utilisation parcimonieuse de ces antibiotiques.
De façon générale, une corrélation négative représente une hausse de l’utilisation associée à une baisse de la résistance ou encore une baisse de l’utilisation associée à une hausse de la résistance. Dans un contexte exploratoire, ces corrélations négatives ne s’expliquent pas. Toutefois, on peut mentionner que la corrélation négative impliquant les couples Klebsiella spp-tobramycine et entérobactéries-tobramycine pourrait s’expliquer par le retrait de cet antibiotique dans l’algorithme de prise en charge de la neutropénie fébrile. Pour les couples SCN-TMP/SMX et SCN-vancomycine, la corrélation négative pourrait s’expliquer par la difficulté de distinguer une réelle bactériémie d’une contamination causée par des germes peu virulents tels que les SCN, dans les cas où une seule hémoculture est prélevée chez les prématurés.
L’approche développée et testée dans cette étude pourrait profiter d’une mise en ligne périodique du profil de consommation et de résistances aux antibiotiques (soit, un antibiogramme cumulatif) dans une base de données en programmant des requêtes permettant de vérifier périodiquement la présence de corrélation. En outre, même s’il n’existe pas de corrélation entre l’utilisation réelle et le taux de résistance pour un couple antibiotique-bactérie, la surveillance du taux de résistance reste incontournable.
Cette étude descriptive comporte des limites. Les données recueillies portent sur un établissement mère-enfant ciblant deux clientèles pédiatriques. D’autres travaux doivent être menés auprès d’établissements similaires ou comportant d’autres types de clientèles pour généraliser cette approche. Toutefois, même si cette étude montre qu’il est possible d’explorer la relation entre la consommation d’antibiotiques et la résistance, elle ne permet pas d’établir de lien de causalité compte tenu de l’exposition des patients décrits aux antibiotiques en prophylaxie, en traitement ou par l’alimentation. En outre, au cours de leur vie, les enfants ont été moins exposés aux antibiotiques que les adultes. Le profil des résistances est susceptible de différer d’une étude menée dans un centre hospitalier adulte. Le profil des résistances varie également entre régions et pays.
Il est possible d’explorer l’association qui peut exister entre la consommation d’antibiotiques et l’émergence de résistance dans un centre hospitalier universitaire mère-enfant. De tous les couples bactérie-antibiotiques ciblés, notre étude met en évidence une corrélation positive entre la consommation d’antibiotiques et la résistance pour six couples antibiotique-bactérie en hémato-oncologie et trois couples en néonatologie. L’approche exploratoire proposée repose sur un traitement manuel des données. Il pourrait être intéressant d’envisager une approche systématique continue permettant de produire les corrélations de façon automatique.
1 Davies J, Davies D. Origins and evolution of antibiotic resistance. Microbiol Mol Biol Rev. 2010;74(3):417–33.
Crossref PubMed PMC
2 Centers for Disease Control and Prevention. About antibiotic resistance [en ligne]. 2020 [cité le 25 juin 2021]. Disponible : https://www.cdc.gov/drugresistance/about.html
3 Strathdee SA, Davies SC, Marcelin JR. Confronting antimicrobial resistance beyond the COVID-19 pandemic and the 2020 US election. Lancet. 2020;396(10257):1050–3.
Crossref PubMed PMC
4 Public Health Agency of Canada. Canadian antimicrobial resistance surveillance system. Update 2018 [en ligne]. 2018 [cité le 19 octobre 2021]. Disponible : https://www.canada.ca/content/dam/phac-aspc/documents/services/publications/drugs-health-products/canadian-antimicrobial-resistance-surveillance-system-2018-report-executive-summary/pub1-eng.pdf
5 Agence de la santé publique du Canada. Programme Canadien de Surveillance des Infections Nosocomiales (PCSIN) : Rapport sommaire sur les données de surveillance des infections associées aux soins de santé (IASS), la résistance aux antimicrobiens (RAM) et l’utilisation des antimicrobiens (UAM) du 1er janvier 2013 au 31 décembre 2017 [en ligne]. 2019 [cité le 19 octobre 2021]. Disponible : https://www.canada.ca/content/dam/canada/public-health/services/publications/science-research-data/summary-report-healthcare-associated-infection-antimicrobial-resistance-antimicrobial-use-surveillance-data-2013-2017/CNISP-2013-2017-Report-FR-WEB-05-03-2019.pdf
6 Zhanel GG, Adam HJ; Canadian Antimicrobial Resistance Alliance (CARA) and CANWARD. Ten years of the CANWARD Study (2007–16). J Antimicrob Chemother. 2019;74(Suppl 4):iv2–iv4.
Crossref PubMed
7 World Health Organization. Antibiotic resistance [en ligne]. 2020 [cité le 25 juin 2021]. Disponible : https://www.who.int/news-room/fact-sheets/detail/antibiotic-resistance
8 World Health Organization. Antimicrobial resistance: global report on surveillance [en ligne]. 2014 [cité le 25 juin 2021]. Disponible : https://apps.who.int/iris/handle/10665/112642
9 World Health Organization. Global action plan on antimicrobial resistance [en ligne]. 2015 [cité le 25 juin 2021]. Disponible : https://apps.who.int/iris/handle/10665/193736
10 World Health Organization. AWaRe classification antibiotics [en ligne]. 2019 [cité le 25 juin 2021]. Disponible : https://www.who.int/medicines/news/2019/WHO_releases2019AWaRe_classification_antibiotics/en/
11 Agrément Canada. Pratiques organisationnelles requises. Antibiogouvernance [en ligne]. S.d. [cité le 28 octobre 2021]. Disponible : https://accreditation.ca/ca-fr/
12 Ministère de la santé et des services sociaux du Québec. D’abord, ne pas nuire… Les infections nosocomiales au Québec, un problème majeur de santé, une priorité. Rapport du comité d’examen sur la prévention et le contrôle des infections nosocomiales [en ligne]. 2005 [cité le 25 juin 2021]. Disponible : https://publications.msss.gouv.qc.ca/msss/fichiers/2005/05-209-01W.pdf
13 Ministère de la santé et des services sociaux du Québec. Mise en œuvre d’un programme de surveillance de l’usage des antibiotiques en établissement de santé. Circulaire 2011–021 [en ligne]. 2011 [cité le 25 juin 2021]. Disponible : http://msssa4.msss.gouv.qc.ca/fr/document/d26ngest.nsf/1f71b4b2831203278525656b0004f8bf/64dda98c0e305cc4852578b70065be3c/$FILE/2011-021_Circulaire%20(2011-06-10).pdf
14 Institut national de santé publique du Québec. Comité central de surveillance provinciale des infections nosocomiales [en ligne]. S.d. [cité le 25 juin 2021]. Disponible : https://www.inspq.qc.ca/infections-nosocomiales/spin
15 Delisle G, Quach C, Domingo MC, Boudreault AA, Gourdeau M, Bernatchez H, et al. Escherichia coli antimicrobial susceptibility profile and cumulative antibiogram to guide empirical treatment of uncomplicated urinary tract infections in women in the province of Québec, 2010–15. J Antimicrob Chemother. 2016;71(12):3562–7.
Crossref PubMed
16 Clinical and Laboratory Standards Institute. Analysis and presentation of cumulative antimicrobial susceptibility test data, 4th edition. M.39 [en ligne]. S.d. [cité le 25 juin 2021]. Disponible : https://clsi.org/standards/products/microbiology/documents/m39/
17 Polk RE, Fox C, Mahoney A, Letcavage J, MacDougall C. Measurement of adult antibacterial drug use in 130 US hospitals: comparison of defined daily dose and days of therapy. Clin Infect Dis. 2007; 44(5):664–70.
Crossref PubMed
18 Fortin É, Fontela PS, Manges AR, Platt RW, Buckeridge DL, Quach C. Measuring antimicrobial use in hospitalized patients: a systematic review of available measures applicable to paediatrics. J Antimicrob Chemother. 2014;69(6):1447–56.
Crossref PubMed
19 Grammatico-Guillon L, Abdurrahim L, Shea K, Astagneau P, Pelton S. Scope of antibiotic stewardship programs in pediatrics. Clin Pediatr (Phila). 2019;58(11–12):1291–301.
Crossref
20 Gerber JS, Hersh AL, Kronman MP, Newland JG, Ross RK, Metjian TA. Development and application of an antibiotic spectrum index for benchmarking antibiotic selection patterns across hospitals. Infect Control Hosp Epidemiol. 2017;38(8):993–7.
Crossref PubMed
21 Horikoshi Y, Suwa J, Higuchi H, Kaneko T, Furuichi M, Aizawa Y, et al. Sustained pediatric antimicrobial stewardship program with consultation to infectious diseases reduced carbapenem resistance and infection-related mortality. Int J Infect Dis. 2017;64:69–73.
Crossref PubMed
22 Bell BG, Schellevis F, Stobberingh E, Goossens H, Pringle M. A systematic review and meta-analysis of the effects of antibiotic consumption on antibiotic resistance. BMC Infect Dis. 2014;14:13.
Crossref PubMed PMC
23 Costelloe C, Metcalfe C, Lovering A, Mant D, Hay AD. Effect of antibiotic prescribing in primary care on antimicrobial resistance in individual patients: systematic review and meta-analysis. BMJ. 2010;340:c2096.
Crossref PubMed
24 Shapiro JT, Leboucher G, Myard-Dury AF, Girardo P, Luzatti A, Mary M, et al. Metapopulation ecology links antibiotic resistance, consumption, and patient transfers in a network of hospital wards [en ligne]. eLife. 2020;9:e54795. Disponible : https://elifesciences.org/articles/54795 et https://doi.org/10.7554/eLife.54795
Crossref
25 Centers for Disease Control and Prevention. Antibiotic resistance threats in the US [en ligne]. 2019 [cité le 25 juin 2021]. Disponible : https://www.cdc.gov/drugresistance/biggest-threats.html
Conflits d’intérêt : Aucune déclaration. ( Return to Text )
Financement : Aucun reçu. ( Return to Text )
Canadian Journal of Hospital Pharmacy, VOLUME 75, NUMBER 3, Summer 2022