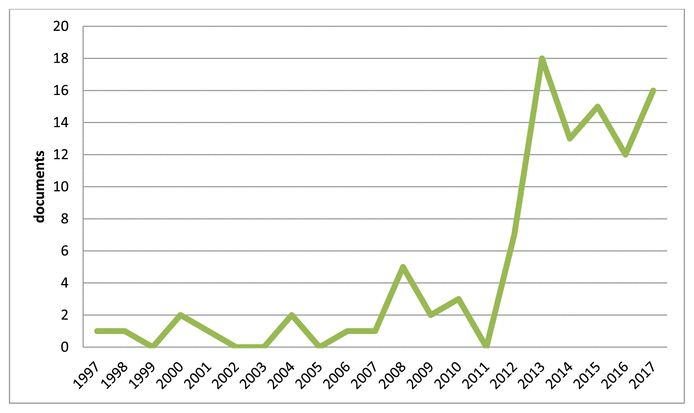
FIGURE 1 Évolution du nombre des publications sur les interférences des médicaments avec les examens biologiques en fonction du temps.
Imene Ben Jdidia , Kaouther Zribi , Meriam Boubaker , Amira Brahem , Mouna Sayadi , Marwa Tlijani , Zahra Saidani , Amani Cherif
RÉSUMÉ
Contexte
Le bilan biologique fait partie intégrante du processus de diagnostic qui oriente les décisions de prise en charge thérapeutique. Cependant, ces analyses restent sujettes à des interférences endogènes ou exogènes qui altèrent le résultat.
Objectif
L’objectif de notre travail était de fournir un aperçu actualisé et complet des interférences les plus documentées dues aux médicaments, afin que l’interprétation des résultats soit fiable et la prise en charge du patient, meilleure.
Sources des données
Il s’agit d’une revue systématique exhaustive de la littérature réalisée en 2018. La recherche bibliographique a été réalisée dans différentes bases de données en ligne, à savoir Pubmed, ScienceDirect et Google Scholar.
Sélections des études
Seules les publications en français ou en anglais concernant les médicaments à usage humain ont été retenues. Les interférences avec les examens biologiques, dues aux médicaments, que les investigateurs ont étudiées, concernaient uniquement le dosage sanguin (sérum/plasma).
Extraction des données
Un tableur Excel a servi à exploiter les résultats. Au total, 82 articles ont été retenus. Les interférences étudiées touchaient 47 paramètres biologiques correspondant à différents bilans : bilan hormonal, bilan hépatique, bilan rénal.
Synthèse des données
Les mécanismes rapportés dans notre littérature étaient à 56,9 % d’ordre analytique, à 17,82 % d’ordre physiologique et à 20,11 % d’ordre pharmacologique. Le reste des mécanismes (5,17 %) n’étaient pas définis.
Conclusions
Les cliniciens devraient être vigilants lors de la validation et de l’interprétation des résultats d’un examen biologique pour les patients recevant ces types de médicaments. Enfin le dialogue clinico-biologiste est la meilleure garantie pour éviter des explorations complémentaires inutiles, souvent lourdes et coûteuses.
MOTS CLÉS: médicaments , bilans biologiques , interférence avec les examens biologiques , due aux médicaments ( drug-related laboratory test interference [DLTI])
RÉSUMÉ
Background
Biological assessment is an integral part of the diagnostic process that guides therapeutic management decisions. However, these analyses remain subject to interference from endogenous or exogenous factors, which may alter the results.
Objective
To provide an up-to-date and comprehensive overview of the most commonly documented types of interference attributable to medications, to ensure reliable interpretation of test results and better management of patients.
Data Sources
This comprehensive systematic review of the literature was carried out in 2018. The bibliographic search was carried out in various online databases, specifically PubMed, ScienceDirect and Google Scholar.
Study Selection
Only publications in French or English concerning medicinal products for human use were retained. The investigators’ examination of drug-related interference with laboratory tests was limited to blood assays (serum or plasma).
Data Extraction
An Excel spreadsheet was used to analyze the results. A total of 82 articles were selected. The interferences studied affected 47 biological parameters corresponding to various types of assessment: hormonal, hepatic, and renal.
Data Synthesis
The mechanisms reported in the literature identified were analytical (56.9%), physiological (17.82%), and pharmacological (20.11%). The remainder of the mechanisms (5.17%) were not defined.
Conclusions
Clinicians should be vigilant in validating and interpreting laboratory test results for patients receiving these types of drugs. Dialogue between clinicians and biological scientists is the best way to avoid unnecessary additional testing, which is often cumbersome and costly.
KEYWORDS: drugs , biological assessments , drug-related laboratory test interference (DLTI)
Les décisions de prise en charge thérapeutique en médecine humaine sont toutes orientées par une démarche diagnostique qui comprend plusieurs examens parmi lesquels le bilan biologique.
Soixante-dix pour cent des décisions médicales sont basées sur les résultats des examens biologiques du laboratoire et jouent un rôle de plus en plus important dans le parcours de soins 1.
À ce jour, environ 4000 tests biologiques différents ont été mis au point, dont des tests en hématologie, en biochimie, en bactériologie etc. 2. L’amélioration de leurs performances, sensibilités, spécificités et reproductibilités se poursuit continuellement. Cependant, ces analyses restent sujettes à des interférences endogènes ou exogènes qui peuvent altérer le résultat, ce qui conduit à d’autres tests inappropriés, à des diagnostics erronés et à des traitements potentiellement défavorables pour le patient 3. Les médicaments font partie des principales sources de ces interférences. La Food and Drug Administration a introduit aussi la notion de Drug-related laboratory test interference (DLTI) ou « interférence avec les examens biologiques, due aux médicaments » 2. Malgré l’influence significative de plusieurs médicaments sur les résultats de certains paramètres biologiques, de nombreux cliniciens accordent peu d’importance à ces effets, puisqu’ils se concentrent uniquement sur l’intention thérapeutique du médicament 4.
Jusqu’à présent, la littérature rapporte plus de 40 000 DLTI. Néanmoins, peu d’études ont tenté de fournir un résumé global sur les données portant sur ce sujet.
Des revues systématiques de la littérature présentant une analyse des données seraient indispensables.
Dans ce cadre, l’objectif de notre étude est de fournir un aperçu actualisé et complet des interférences les plus documentées dues aux médicaments, pouvant servir de guide pratique pour les biologistes et les cliniciens afin qu’ils soient en mesure de faire une interprétation fiable des résultats et d’améliorer la prise en charge du patient.
Il s’agit d’une revue systématique exhaustive de la littérature, réalisée en 2018.
Les références bibliographiques présentant l’interférence des médicaments avec les bilans biologiques ont été répertoriées. La recherche bibliographique a été réalisée dans différentes bases de données en ligne, à savoir PubMed, ScienceDirect et Google Scholar. Seules les publications en français et en anglais concernant les médicaments à usage humain ont été retenues. Les DLTI étudiées concernaient uniquement le dosage sanguin (sérum/plasma). Les autres échantillons, tels que l’urine, ont donc été exclus de cette étude.
La stratégie de recherche suivante a été utilisée : les mots clés utilisés seuls ou combinés : interference , interfering , interfere , drug , drugs , médicaments, drugs effects , laboratory tests , laboratory assays , renal function tests , thyroïd function test , analytical interferences , physiological interferences .
La recherche électronique a été complétée par une sélection des articles trouvés.
Dans un premier temps, l’utilisation d’un tableur Excel a permis l’exploitation de toute l’information pertinente décrite dans chacun des documents retenus. Les paramètres suivants de chaque médicament figurant dans le tableau ont été recueillis : dénomination commune internationale (DCI), le paramètre biologique dont le dosage est affecté, l’effet spécifique sur le dosage ou encore le sens de la variation (si disponible), le mécanisme de l’interférence ainsi que la méthode concernée et enfin la référence de cette information. La classe pharmacologique a été désignée selon l’usage thérapeutique du médicament.
Dans un deuxième temps, nous avons sélectionné les interférences qui ont été citées au moins trois fois, c’est-à-dire dans trois article différents.
Au total, 82 articles ont été retenus, dont 56 % dataient de moins de cinq ans au moment de la revue. L’article le plus ancien datait de 1972 et le plus récent de 2018.
La littérature met à notre disposition de nombreuses références concernant les DLTI. Le nombre de publications consultées dans cette étude s’accroît de plus en plus au fil des ans, en particulier ces dernières années, comme le montre la figure 1 « Évolution du nombre des publications sur les interférences des médicaments avec les examens biologiques en fonction du temps ».
|
|
||
|
FIGURE 1 Évolution du nombre des publications sur les interférences des médicaments avec les examens biologiques en fonction du temps. |
||
Soixante-neuf interférences ont été collectées et saisies sur le tableur Excel. Les DLTI étudiées touchaient 47 paramètres biologiques correspondant à différents bilans : bilan hormonal, bilan hépatique, bilan rénal, etc.
Les résultats sont exprimés dans le tableau 1 récapitulatif des DLTI analytiques les plus citées1,2,5–84.
TABLEAU 1
Tableau récapitulatif des interférence avec les examens biologiques, due aux médicaments (
drug-related laboratory test interference
[DLTI]) analytiques les plus citéesa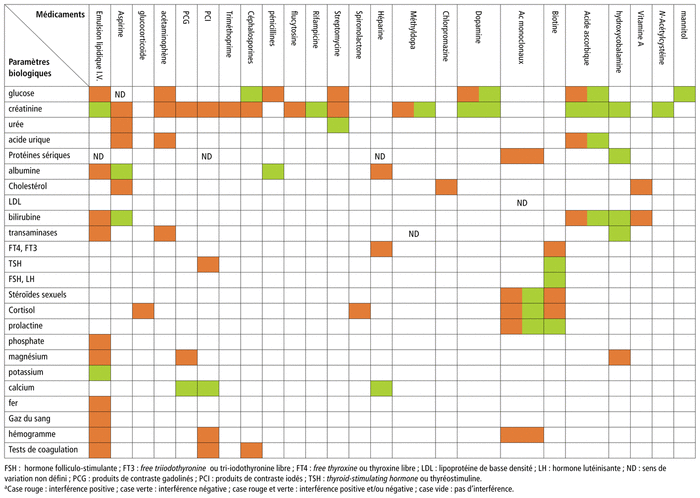
D’après notre étude, les médicaments peuvent avoir un impact sur les résultats des tests de laboratoire selon différents mécanismes. Ainsi, cet impact peut être d’ordre pharmacologique (ADME : absorption, distribution, métabolisme et excrétion). En effet, l’absorption de certains médicaments peut modifier les paramètres à analyser à travers le bilan biologique. À titre d’exemple, nous citons les inhibiteurs de l’enzyme de conversion qui modifient la glycémie, l’aldostéronémie, etc. Cette interférence est atténuée après l’excrétion du médicament en cause8,10,83. Un autre mécanisme consiste à modifier l’échantillon biologique testé (par exemple l’hémolyse dans le sang) : interférence physiologique. Certains médicaments interfèrent également directement avec le test lui-même en réagissant avec les réactifs du test : interférence analytique.
Les mécanismes rapportés dans notre littérature étaient les suivants : 56,9 % d’ordre analytique, 17,82 % d’ordre physiologique et 20,11 % d’ordre pharmacologique. Le reste des mécanismes (5,17 %) n’étaient pas définis.
Les mécanismes des interférences des différentes classes médicamenteuses avec les bilans biologiques ont été rapportés dans le document supplémentaire (disponible au https://www.cjhp-online.ca/index.php/cjhp/issue/view/206)1,2,5–12,14–43,45–84.
Les résultats des études bibliographiques relatives à ces interférences ont montré que les émulsions lipidiques administrées par voie intraveineuse (IV) sont la classe de médicaments qui risque le plus d’interférer avec les tests de laboratoire par des mécanismes essentiellement d’ordre analytique, à savoir : interaction des particules de lipoprotéines avec les réactifs de dosage et présence d’excipients causant une réactivité croisée sur les méthodes de dosage de triglycérides lipases6.
Les médicaments anti-infectieux se trouvent au deuxième rang des agents qui risquent le plus d’interférer avec les tests de laboratoire, les céphalosporines en tête de liste et particulièrement céfoxitine, céfuroxime, céfazoline et céfixime. Les tests qui risquent le plus d’être affectés par ces interférences sont les dosages de créatininémie et de glycémie2.
Les médicaments du système nerveux (SN) figurent aussi parmi les principaux xénobiotiques impliqués dans les DLTI. Les agents antidépresseurs, anti-parkinsoniens et antipsychotiques étaient tous inclus dans la catégorie des médicaments du SN, car ils entraînent des changements dans le fonctionnement cérébral et entraînent des altérations de la perception, de l’humeur et/ou de la conscience. La détermination du fait qu’un patient réagit positivement à un médicament, tel que la phencyclidine, l’amphétamine ou les benzodiazépines, peut être influencée par d’autres médicaments du SN que prend le patient. Cette interférence s’explique par la similarité entre la structure des médicaments à base de phencyclidine, d’amphétamine et de benzodiazépines et les autres médicaments du SN ou de leurs métabolites. Le personnel de laboratoire et les cliniciens doivent garder à l’esprit cette possibilité d’interférence, car cela peut conduire à des conclusions incorrectes concernant la conformité.
Les produits de contraste sont une autre classe importante de médicaments qui interfèrent avec les tests de laboratoire. Un produit de contraste médical est une substance utilisée pour améliorer le contraste des structures ou des fluides dans le corps pendant l’imagerie médicale1. Les agents de contraste au gadolinium sont généralement utilisés en imagerie par résonance magnétique, tandis que les molécules d’iode organique sont les produits de contraste le plus couramment utilisés pour l’amélioration des méthodes d’imagerie à base de rayons X. Ces derniers, à cause de leur haute densité, peuvent augmenter la densité du plasma ou du sérum à tel point qu’elle dépasse celle des séparateurs de gel. Ils provoquent ainsi la formation d’une barrière de gel inappropriée dans les tubes sanguins, ce qui affecte la détermination des taux de protéines dans le sang quand on recourt à certaines méthodes5.
Les interférences étudiées montrent l’existence d’un impact clinique des DLTI. L’acide ascorbique qui interfère positivement avec la mesure de la glycémie par la plupart des dispositifs d’autosurveillance basés sur l’enzyme glucose oxydase ou glucose déshydrogénase en est un exemple. Kim et collab.74 rapportent qu’à la suite de cette interférence, l’injection d’une dose élevée d’insuline a entrainé une hypoglycémie. Leur étude a montré également que les DLTI masquant une hypo/hyperglycémie sont menaçantes pour la vie et surtout quand il s’agit d’une fausse hyperglycémie.
Outre les conséquences cliniques, les DLTI sont capables d’engendrer un coût supplémentaire considérable en raison du traitement inapproprié des patients ou des investigations complémentaires. À titre d’exemple, le coût des réactifs consommés pour les essais répétés du dosage de la calcémie à la suite d’une suspicion d’interférence par le gadoversamide pour un seul échantillon est de 0,76 $, ce qui engendre un surcoût en terme de réactif estimé à 481 $ (633 × 0,76 $ : 633 étant le nombre de fois où le test a été répété). Ainsi, le coût total des analyses supplémentaires de cette interférence était de 3 132 $ pour tous les échantillons traités pendant toute la période de l’étude85.
L’évolution du nombre d’articles reflète l’intérêt de la recherche scientifique pour les DLTI et l’importance de cette problématique.
En effet, les interférences que produisent les médicaments sur les tests biologiques signifient que les résultats de laboratoire peuvent être faussés par un médicament qui interfère avec le test (par exemple, un résultat faussement positif ou négatif ne reflète pas précisément la quantité, la présence ou l’absence de la substance analysée).
Les interférences des examens biologiques en général engendrent un taux d’erreurs pouvant atteindre 40 %62. Lorsque des approches pour éliminer les substances qui produisent des interférences sont incorporées dans la méthodologie d’essai, le taux d’erreurs peut baisser jusqu’à 0,1 %62. Cependant, il n’est pas toujours facile de prévoir une interférence. On la découvre souvent fortuitement, comme dans le cas où les résultats se révèlent discordants par rapport au tableau clinique du patient.
La majorité des études publiées sur les DLTI mentionnent que la polymédication augmente le risque des interférences médicamenteuses. Une étude datant de 1998 a évalué l’interférence de divers médicaments sur des tests de laboratoire; le pourcentage de tests affectés par l’interférence était de 7 % lorsque le patient prenait un médicament, de 16,7 % lorsque le patient prenait deux médicaments, de 66,7 % lorsque le patient prenait trois ou quatre médicaments et de 100 % lorsque le patient prenait cinq médicaments86.
Si une interférence n’est pas démasquée, les conséquences de résultats erronés peuvent être d’ordre clinique (l’impact varie d’un risque minime jusqu’à la perte de la possibilité de traiter ou à une thérapie inappropriée qui pourrait conduire à la morbidité ou à la mort), économique et même fausser les résultats de recherches cliniques (par la publication de conclusions erronées dans la littérature scientifique).
Les fabricants d’instruments et de réactifs et les développeurs de méthodes représentent la « première ligne » idéale permettant de détecter les DLTI potentiels. En effet, ils ont une connaissance approfondie des réactifs utilisés ainsi que des informations appartenant au fabricant, qui ne sont pas mises à la disposition des utilisateurs, mais qui pourraient aider à prévoir les interactions.
De plus, il serait possible de mettre en œuvre des évaluations standardisées des DLTI potentiels lors des essais cliniques.
Par ailleurs, on peut remédier à ces DLTI en mettant en place des protocoles particuliers pour certaines interférences connues et bien décrites. On cite l’exemple des produits de contraste qui peuvent interférer avec le dosage colorimétrique du zinc et de l’enzyme de conversion de l’angiotensine. Ce même produit peut aussi interférer avec la détermination de la créatinine par la réaction de Jaffe39. Etant donné que la demi-vie d’élimination des produits de contraste est habituellement inférieure à deux heures, les prélèvements sanguins devraient avoir lieu après cette période pour les patients ayant reçu ces composés à des fins diagnostiques. Il est également préférable d’opter pour des méthodes de dosage qui ne sont pas affectées par ce type d’interférences, du moins pour ces patients36.
Il est aussi possible d’avoir recours à de nombreuses procédures pour réduire l’effet de l’interférence des émulsions lipidiques intraveineuses avec les bilans biologiques, à savoir : centrifugation à haute vitesse, utilisation d’agents clarifiants ou de solvants organiques et mesures spectrales à plusieurs longueurs d’ondes et emploi d’un réactif destiné à la clarification des échantillons riches en triglycérides en se liant aux chylomicrons et/ou VLDL qui est une lipoprotéine de très basse densité18,26.
Il en est de même pour la classe des anti-infectieux, car ils peuvent interférer avec le dosage de la glycémie par la méthode réductimétrique. Cependant, cette méthode est de moins en moins courante dans les laboratoires d’analyses, en raison des interférences documentées ; ainsi, la quasi-totalité des études recommandent le dosage du glucose par des réactions enzymatiques à l’enzyme glucose oxydase ou à l’hexokinase2,8.
En milieu clinique, l’enregistrement des DLTI nécessitera la prise en compte de l’historique détaillée et précise, ainsi qu’une amélioration du transfert des dossiers médicaux entre les établissements.
Il faut souligner auprès des patients l’importance de connaître et de fournir des informations complètes et précises sur leur médication. De même, le personnel de laboratoire doit s’assurer que ces informations ont été obtenues auprès de tous les patients, ce qui aiderait à prévoir les interférences potentielles.
Cette étude a montré que les émulsions lipidiques administrées par voie IV, les médicaments anti-infectieux, les médicaments du SN et les produits de contrastes tendent davantage à provoquer des DLTI. Ces médicaments représentent également la majorité des traitements utilisés dans les hôpitaux et les cliniques.
Par conséquent, la communication entre les différents acteurs, prescripteurs, pharmaciens, préleveurs et biologistes permet la transmission de renseignements pouvant améliorer le jugement de la cohérence clinico-biologique du résultat de l’examen prescrit. Dans ce contexte, un dialogue clinico-biologique bien conduit permettrait de suspecter une interférence possible.
Comme il est impossible de se souvenir de toutes les interférences in vitro, in vivo pour chaque paramètre biologique, une base de données en ligne, la notification automatisée des résultats de laboratoire et le dossier médical électronique sont des stratégies nécessaires qui devraient être mises en œuvre dès que possible pour limiter l’impact clinique des DLTI.
1 Cornes MP. Exogenous sample contamination. Sources and interference. Clin Biochem. 2016;49(18):1340–5.
Crossref PubMed
2 Yao H, Rayburn ER, Shi Q, Gao L, Hu W, Li H. FDA-approved drugs that interfere with laboratory tests: a systematic search of US drug labels. Crit Rev Clin Lab Sci. 2017;54(1):1–17.
Crossref
3 Dimeski G. Interference testing. Clin Biochem Rev. 2008;29 Suppl 1:S43–8
PubMed PMC
4 Sonntag O. Analytical interferences and analytical quality. Clin Chim Acta. 2009;404(1):37–40
Crossref PubMed
5 Lippi G, Daves M, Mattiuzzi C. Interference of medical contrast media on laboratory testing. Biochem Med. 2014;24(1):80–8.
Crossref
6 Nikolac N. Lipemia: causes, interference mechanisms, detection and management. Biochem Med. 2014;24(1):57–67.
Crossref
7 Luna-Záizar H, Virgen-Montelongo M, Cortez-Alvarez CR, Ruiz-Quezada SL, Escutia-Gutiérrez R, Garcia-Lemus CR, et al. In vitro interference by acetaminophen, aspirin, and metamizole in serum measurements of glucose, urea, and creatinine. Clin Biochem. 2015; 48(8):538–41.
Crossref PubMed
8 Yadav S, Sanjaya KS. Interference of drugs on clinical chemistry—shall we start thinking? J Nepal Chem Soc. 2013;29:89–95.
Crossref
9 Martinello F, da Silva EL. Ascorbic acid interference in the measurement of serum biochemical parameters: in vivo and in vitro studies. Clin Biochem. 2006;39(4):396–403.
Crossref PubMed
10 Godouet-Getti B, Loeber D. Interférences médicamenteuses et dosages hormonaux en endocrinologie. Metab Horm Diabetes Nutr. 2007;11(2):52–63.
11 Samra M, Abcar AC. False estimates of elevated creatinine. Perm J. 2012;16(2):51–2.
Crossref PubMed PMC
12 Stevens PE, Levin A; Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann Intern Med. 2013;158(11):825–30.
Crossref PubMed
13 Lognard M, Cavalier E, Chapelle JP, Lambermont B, Krzesinski JM, Delanaye P. Acetylcysteine and enzymatic creatinine: beware of laboratory artefact! Intensive Care Med. 2008;34(5):973–4.
Crossref
14 Godwin Z, Lima K, Greenhalgh D, Palmieri T, Sen S, Tran NK. A retrospective analysis of clinical laboratory interferences caused by frequently administered medications in burn patients. J Burn Care Res. 2016;37(1):10–7.
Crossref
15 Samarasinghe S, Meah F, Singh V, Basit A, Emanuele N, Emanuele MA, et al. Biotin interference with routine clinical immunoassays: understand the causes and mitigate the risks. Endocr Pract. 2017;23(8):989–98.
Crossref
16 Sapin R. Interférences dans les immunodosages : mécanismes et conséquences en endocrinologie. Ann Endocr. 2008;69(5):415–25.
Crossref
17 Rispens T, Hart MH, Ooijevaar-de Heer P, van Leeuwen A, Vennegoor A, Killestein J, et al. Drug interference in immunogenicity assays depends on valency. J Pharm Biomed Anal. 2013;85:179–85.
Crossref PubMed
18 Grunbaum AM, Gilfix BM, Gosselin S, Blank DW. Analytical interferences resulting from intravenous lipid emulsion. Clin Toxicol. 2012;50(9):812–7.
Crossref
19 Grunbaum AM, Gilfix BM, Hoffman RS, Lavergne V, Morris M, Miller-Nesbitt A, et al. Review of the effect of intravenous lipid emulsion on laboratory analyses. Clin Toxicol. 2016;54(2):92–102.
Crossref
20 Johnson-Arbor K, Salinger L, Luczycki S. Prolonged laboratory interference after administration of intravenous lipid emulsion therapy. J Med Toxicol. 2015;11(2):223–6.
Crossref PMC
21 Levine M, Skolnik AB, Ruha AM, Bosak A, Menke N, Pizon AF. Complications following antidotal use of intravenous lipid emulsion therapy. J Med Toxicol. 2014;10(1):10–4.
Crossref
22 Mainali S, Davis SR, Krasowski MD. Frequency and causes of lipemia interference of clinical chemistry laboratory tests. Pract Lab Med. 2017;8:1–9.
Crossref PMC
23 Caraway WT, Kammeyer CW. Chemical interference by drugs and other substances with clinical laboratory test procedures. Clin Chim Acta. 1972;41:395–434.
Crossref PubMed
24 Farrell CJ, Carter AC. Serum indices: managing assay interference. Ann Clin Biochem. 2016;53(5):527–38.
Crossref
25 Jones GR, Hawkins RC. Correcting laboratory results for the effects of interferences: an approach incorporating uncertainty of measurement. Ann Clin Biochem. 2015;52(2):226–31.
Crossref
26 Saracevic A, Nikolac N, Simundic AM. The evaluation and comparison of consecutive high speed centrifugation and LipoClear® reagent for lipemia removal. Clin Biochem. 2014;47(5):309–14.
Crossref PubMed
27 Koulouri O, Moran C, Halsall D, Chatterjee K, Gurnell M. Pitfalls in the measurement and interpretation of thyroid function tests. Best Pract Res Clin Endocrinol Metab. 2013;27(6):745–62.
Crossref
28 Leon A. Mise en évidence d’une macrocréatine kinase induite par la prise de ténofovir: de l’analyse des resultants de l’étude clinico-biologique nancéienne à la mise en place d’une enquête de pratique professionnelle nationale [thèse]. Université de Lorraine, Faculté de pharmacie; 2013.
29 Saifee NH, Ranjitkar P, Greene DN. Factors influencing naproxen metabolite interference in total bilirubin assays. Clin Biochem. 2016; 49(6):514–7.
Crossref
30 Vinay P, Comtois R, Petitclerc C, Pavlov I, Gagnon L, Seck M. Physiologie du mourir : hypothyroïdie en soins palliatifs. Med Palliat. 2012; 11(1):3–9.
31 Heinemann L. Quality of glucose measurement with blood glucose meters at the point-of-care: relevance of interfering factors. Diabetes Technol Ther. 2010;12(11):847–57.
Crossref
32 Tang Z, Du X, Louie RF, Kost GJ. Effects of drugs on glucose measurements with handheld glucose meters and a portable glucose analyzer. Am J Clin Pathol. 2000;113(1):75–86.
Crossref
33 Erbach M, Freckmann G, Hinzmann R, Kulzer B, Ziegler R, Heinemann L, et al. Interferences and limitations in blood glucose self-testing. J Diabetes Sci Technol. 2016;10(5):1161–8.
Crossref PMC
34 Ajmal A, Joffe H, Nachtigall LB. Psychotropic-induced hyperprolactinemia: a clinical review. Psychosomatics. 2014;55(1):29–36.
Crossref
35 Delanaye P, Cavalier E, Maillard N, Krzesinski JM, Mariat C, Cristol JP, et al. La créatinine : d’hier à aujourd’hui. Ann Biol Clin. 2010; 68(5):531–43.
36 Proctor KA, Rao LV, Roberts WL. Gadolinium magnetic resonance contrast agents produce analytic interference in multiple serum assays. Am J Clin Pathol. 2004;121(2):282–92.
Crossref PubMed
37 Darby D, Broomhead C. Interference with serum indices measurement, but not chemical analysis, on the roche modular by patent blue V. Ann Clin Biochem. 2008;45(3):289–92.
Crossref
38 Emerson J, Kost G. Spurious hypocalcemia after Omniscan- or OptiMARK-enhanced magnetic resonance imaging: an algorithm for minimizing a false-positive laboratory value. Arch Pathol Lab Med. 2004;128(10):1151–6.
Crossref PubMed
39 Yan R, Tarr H, McNally M, Cartier LJ, Chen Y. Interference of gadolinium-based contrast agents on colorimetric calcium assays. Clin Biochem. 2014;47(7):648–53.
Crossref
40 KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Chapter 1: Definition and classification of CKD. Kidney Int Suppl. 2013;3(1):19–62.
41 Chapdelaine I. Pas anodine, la créatinine. 2014 [page consultée le 10 janvier 2018]. [en ligne] : https://pdfhall.com/pas-anodine-la-creatinine_598c8c691723dd57768ccd71.html
42 Gentry CA, Nguyen AT. An evaluation of hyperkalemia and serum creatinine elevation associated with different dosage levels of outpatient trimethoprim-sulfamethoxazole with and without concomitant medications. Ann Pharmacother. 2013;47(12):1618–26.
Crossref
43 Levey AS, Eckfeldt JH. Using glomerular filtration rate estimating equations: clinical and laboratory considerations. Clin Chem. 2015; 61(10):1226–9.
Crossref
44 Syal K, Banerjee D, Srinivasan A. Creatinine estimation and interference. Indian J Clin Biochem. 2013;28(2):210–1.
Crossref PMC
45 Syal K, Srinivasan A, Banerjee D. Streptomycin interference in Jaffe reaction — possible false positive creatinine estimation in excessive dose exposure. Clin Biochem. 2013;46(1):177–9.
Crossref
46 Mistretta V, Charlier C. Dosage immunologique de la digoxine : attention aux interférences ! Toxicol Anal Clin. 2016;28(2):43–5.
47 Puttgen KB, Summerer B, Schneider J, Cohen BA, Boss EF, Bauman NM. Cardiovascular and blood glucose parameters in infants during propranolol initiation for treatment of symptomatic infantile hemangiomas. Ann Otol Rhinol Laryngol. 2013;122(9):550–4.
Crossref PubMed
48 Raza SA, Mahmood N. Subclinical hypothyroidism: controversies to consensus. Indian J Endocrinol Metab. 2013;17(3):636–42.
Crossref
49 Wiewiorka O, Dastych M, Cermakova Z. Strong negative interference of ethamsylate (Dicynone®) in serum creatinine quantification via enzymatic assay using Trinder reaction. Scand J Clin Lab Invest. 2013; 73(5):449–51.
Crossref PubMed
50 Dastych M, Wiewiorka O, Benovska M. Ethamsylate (Dicynone) interference in determination of serum creatinine, uric acid, triglycerides, and cholesterol in assays involving the Trinder reaction; in vivo and in vitro. Clin Lab. 2014;60(8):1373–6.
Crossref PubMed
51 Sankaralingam A, Karim Y, Swaminathan R. Phenindione interferes with measurement of creatinine. Clin Biochem. 2013;46(18):1912–3.
Crossref PubMed
52 Petrides AK, Ness MA, Judge DP, Sokoll LJ, Marzinke MA. Fluctuating creatinine in the cardiac unit. Clin Chim Acta. 2015;447:52–4.
Crossref PubMed
53 Olose EO, Edet J, Igwe MN, Chukwujekwu DC, Aguocha MC, Uwakwe R. Dyslipidaemia and medical outcome (health related quality of life) in patients with schizophrenia taking antipsychotics in Enugu, Nigeria. Psychiatry J. 2017;13:1–9.
Crossref
54 Mitchell AJ, Vancampfort D, Sweers K, van Winkel R, Yu W, De Hert M. Prevalence of metabolic syndrome and metabolic abnormalities in schizophrenia and related disorders: a systematic review and meta-analysis. Schizophr Bull. 2013;39(2):306–18.
Crossref PMC
55 Fabrazzo M, Monteleone P, Prisco V, Perris F, Catapano F, Tortorella A, et al. Olanzapine is faster than haloperidol in inducing metabolic abnormalities in schizophrenic and bipolar patients. Neuropsychobiology. 2015;72(1):29–36.
Crossref
56 Prior SL, de Toledo-Gagliard AR, Caseiro MM, Prior PL. Metabolic alterations associated with antipsychotic use a descriptive study and comparison between haloperidol and olanzapine in schizophrenic and bipolar patients. J Pharmacovigil. 2014;2(5):1–4.
57 Kato Y, Umetsu R, Abe J, Ueda N, Nakayama Y, Kinosada Y, et al. Hyperglycemic adverse events following antipsychotic drug administration in spontaneous adverse event reports. J Pharm Health Care Sci. 2015;1:15–7.
Crossref
58 Feyen BF, Coenen D, Jorens PG, Wouters K, Maas AI, Hoof VV, et al. Falsely elevated sodium levels during thiopental treatment in the ICU: technical interference on a laboratory device with important clinical relevance. Neurocrit Care. 2013;18(1):64–9.
Crossref
59 Garcia-Soler P, Amores-Torres M, Sanchiz-Cárdenas S, González-Gómez JM, Dayaldasani A, Milano-Manso G. Thiopental and false hypernatremia: check your analyzer. Med Intensiva. 2017;41(9):573–4.
60 Vermeer NS. Pharmacovigilance of biologicals dynamics in post-approval safety learning [thèse]. Utrecht Institute for Pharmaceutical Science; 2015.
61 Oostendorp M, Lammerts van Bueren JJ, Doshi P, Khan I, Ahmadi T, Parren PW, et al. When blood transfusion medicine becomes complicated due to interference by monoclonal antibody therapy. Transfusion. 2015;55(6):1555–62.
Crossref
62 Ostrov BE, Amsterdam D. The interference of monoclonal antibodies with laboratory diagnosis: clinical and diagnostic implications. Immunol Invest. 2013;42(8):673–90.
Crossref
63 Brunel C, Widmer C, Augsburger M, Dussy F, Fracasso T. Antidote treatment for cyanide poisoning with hydroxocobalamin causes bright pink discolouration and chemical-analytical interferences. Forensic Sci Int. 2012;223(3):10–2.
Crossref
64 Houzé P, Laforge M, Baud FJ. Lactate blood measurement in acute cyanide poisoning: effect of preanalytical delay and hydroxocobalamin uses as treatment. Ann Biol Clin. 2018;76(1):96–103.
65 Rucheton B, Hugonneau-Beaufet I, Cambon A, Mesli S, Labadie M, Gallart JC, et al. Interférences de l’hydroxocobalamine sur le dosage des paramètres de biochimie d’urgence sur l’automate AU5400 (Beckman Coulter) et sur l’appareil de gaz du sang Rapid Lab 1265 (Siemens). Toxicol Anal Clin. 2017;29(2):66–7.
66 Al-Salameh A, Becquemont L, Brailly-Tabard S, Aubourg P, Chanson P. A Somewhat bizarre case of Graves disease due to vitamin treatment. J Endocr Soc. 2017;1(5):431–5.
Crossref
67 Ali M, Rajapakshe D, Cao L, Devaraj S. Discordant analytical results caused by biotin interference on diagnostic immunoassays in a pediatric hospital. Ann Clin LabSci. 2017;47(5):638–40.
68 Decoudier B, Delemer B, Maarouf A, Tourbah A, Marot D. Une hyperthyroïdie énigmatique de l’importance des interférences dans les dosages hormonaux. Ann Endocrinol. 2015;76(4):428–30.
Crossref
69 Denimal D, Nguyen A, Fromont A, Moreau T, Vergès B, Duvillard L. Interférences des traitements par biotine avec les immunodosages : il est temps de trouver une solution à long terme ! Presse Med. 2018; 47(1):95–7.
Crossref
70 Lam L, Kyle CV. A simple method to detect biotin interference on immunoassays. Clin Chem Lab Med. 2017;55(6):104–6.
Crossref
71 Lim SK, Pilon A, Guéchot J. Biotin interferes with free thyroid hormone and thyroglobulin, but not TSH measurements using Beckman-Access immunoassays. Ann Endocr. 2017;78(3):186–8.
Crossref
72 Elston MS, Sehgal S, Du Toit S, Yarndley T, Conaglen JV. Factitious Graves’ disease due to biotin immunoassay interference: a case and review of the literature. J Clin Endocrinol Metab. 2016;101(9):3251–5.
Crossref PubMed
73 Grimsey P, Frey N, Bendig G, Zitzler J, Lorenz O, Kasapic D, et al. Population pharmacokinetics of exogenous biotin and the relationship between biotin serum levels and in vitro immunoassay interference. Int J Pharmacokinet. 2017;2(4):247–56.
Crossref
74 Kim SK, Hahm JR, Kim HS, Kim S, Jung TS, Jung JH, et al. Spurious elevation of glucose concentration during administration of high dose of ascorbic acid in a patient with type 2 diabetes on hemodialysis. Yonsei Med J. 2013;54(5):1289–92.
Crossref PubMed PMC
75 Vasudevan S, Hirsch IB. Interference of intravenous vitamin C with blood glucose testing. Diabetes Care. 2014;37(5):93–4.
Crossref
76 Bahr RL, Wilson DC. The impact of high-dose vitamin C on blood glucose testing in 18F-FDG PET imaging. J Nucl Med Technol. 2015; 43(1):70–1.
Crossref
77 Sies CW, Florkowski CM, Frampton CM, O’Donnell JL, Chapman PT, Stamp LK. Comparison of two plasma urate assays in patients receiving vitamin C supplementation. Pathology. 2014;46(4):333–5.
Crossref PubMed
78 Biniaz V, Tayebi A, Ebadi A, Sadeghi-Shermeh M, Einollahi B. Effect of vitamin C supplementation on serum uric acid in patients undergoing hemodialysis: a randomized controlled trial. Iran J Kidney Dis. 2014;8(5):401–7.
PubMed
79 Yim J, Cho J, Ahn S, Lee SG, Kim JH. A practical way to overcome ascorbate interference in total cholesterol and triglyceride measurement by exploiting the autoxidation property of ascorbate. Clin Biochem. 2017;50(6):350–1.
Crossref
80 de Cordova CM, Nogara MS, de Cordova MM. Interference on the laboratory measurement of bilirubin: the effect of in vitro interactions. Clin Chim Acta. 2009;407(1):77–9.
Crossref PubMed
81 Genzen JR, Hunsaker JJ, Nelson LS, Faine BA, Krasowski MD. N-Acetylcysteine interference of Trinder-based assays. Clin Biochem. 2016;49(1):100–4.
Crossref
82 Kost GJ, Nguyen TH, Tang Z. Whole-blood glucose and lactate: trilayer biosensors, drug interference, metabolism, and practice guidelines. Arch Pathol Lab Med. 2000;124(8):1128–34.
Crossref PubMed
83 Kailajärvi M, Takala T, Grönroos P, Tryding N, Viikari J, Irjala K, et al. Reminders of drug effects on laboratory test results. Clin Chem. 2000;46(9):1395–400.
Crossref PubMed
84 Forman DT, Young DS. Drug interference in laboratory testing. Ann Clin Lab Sci. 1976;6(3):263–71.
PubMed
85 Gandhi MJ, Narra VR, Brown JJ, Guo A, Grosu DS, Parvin CA, et al. Clinical and economic impact of falsely decreased calcium values caused by gadoversetamide interference. AJR Am J Roentgenol. 2008; 190(3):213–7
Crossref
86 Saibaba KS, Bhaskar MV, Rao PV, Ramana GV, Dakshinamurty KV. Interferences in clinical chemistry analysis. Indian J Clinical Biochem. 1998;13(2):55–62.
Crossref
Conflits d’intérêts: Aucune déclaration. ( Return to Text )
Financement: Aucun reçu. ( Return to Text )
Nota: Cet article comprend un document supplémentaire, disponibles à https://www.cjhp-online.ca/index.php/cjhp/issue/view/206 ( Return to Text )
Canadian Journal of Hospital Pharmacy , VOLUME 74 , NUMBER 4 , Fall 2021